
Wetenschap
Verbeteringen in de cryo-elektronenmicroscopie brengen het leven op atomair niveau duidelijker in beeld
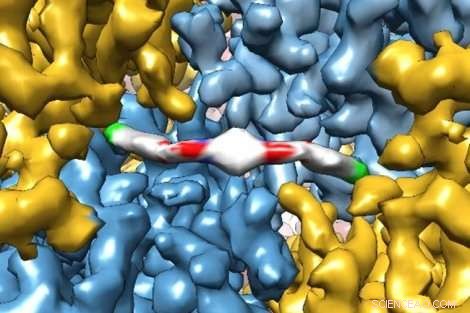
Een baanbrekend beeld met cryo-elektronenmicroscopie laat in extreem detail zien hoe een nieuw therapeutisch molecuul interageert met een eiwit, onderzoekers inzicht geven in hoe het werkt in het menselijk lichaam. het molecuul, ISRIB, werd aangetoond in een recente studie door Peter Walter van UCSF, doctoraat, en Susanna Rosi, doctoraat, om geheugenfalen te herstellen bij patiënten met traumatisch hersenletsel. Krediet:Adam Frost Lab
Onderzoekers van UC San Francisco hebben onlangs prachtige beelden vastgelegd van een eiwit dat is gevangen tijdens het binden aan een nieuw therapeutisch medicijn met voldoende resolutie om te modelleren hoe de individuele atomen van het eiwit en het medicijn in een rij staan.
Tot voor kort, zo'n prestatie zou als onmogelijk worden beschouwd, maar in de afgelopen vijf jaar dergelijke doorbraken zijn hier bijna gemeengoed geworden, onderdeel van een resolutierevolutie die wordt geleid door UCSF-onderzoekers.
Dankzij hun recente vooruitgang in cryo-elektronenmicroscopie (cryo-EM) - een techniek waarvan de uitvinders werden geëerd met de Nobelprijs voor de Scheikunde 2017 - hebben deze onderzoekers snelle vooruitgang mogelijk gemaakt in het zoeken naar preciezere en krachtigere therapieën voor een breed scala aan menselijke ziekten.
Eiwitten zijn kleine moleculaire machines die alles wat onze cellen doen aandrijven - en ze zijn ook de primaire doelen voor farmaceutische medicijnen. Ontdekken hoe nieuwe eiwitten werken, kan leiden tot levensreddende therapieën voor kanker of nieuwe pijnstillers met minder kans op verslaving.
Maar om echt te begrijpen hoe eiwitten werken, onderzoekers moeten ze op atomaire schaal kunnen visualiseren. Voorheen vereiste dit nauwgezet groeiende kristallen van een eiwit - een proces dat jaren kon duren om goed te krijgen - en vervolgens röntgenstralen door de kristallen te schieten om de atomaire samenstelling van het eiwit te berekenen. Helaas, veel van de meest interessante eiwitten en complexen kunnen niet worden gekristalliseerd.
Cryo-EM bestaat al sinds de jaren 70, maar sinds 2013 is de technische vooruitgang gedeeltelijk gepionierd door David Agard van UCSF, doctoraat, en Yifan Cheng, doctoraat, hebben het vermogen van cryo-EM om zowel de kleinste als de meest complexe eiwitten tot in verbluffende details op te lossen drastisch verbeterd, de elektronenmicroscoop bijna van de ene op de andere dag transformeerde van een ouderwets werkpaard uit het laboratorium naar de nieuwste wetenschappelijke superster.
Deze cryo-EM-renaissance werd gestimuleerd door de inspanningen van Agard en Cheng om camerahardware en -software te ontwikkelen die afzonderlijke elektronen kunnen detecteren - een doel dat door het veld lang als onpraktisch werd beschouwd, maar die het duo bereikte door wetenschappers en ingenieurs bij UCSF samen te brengen, Lawrence Berkeley Nationaal Laboratorium, en Gatan, een Pleasanton, Californië, bedrijf dat EM-camera's maakt.
"Niet lang geleden dacht het hele veld dat het tellen van enkele elektronen nooit zou werken, " herinnert Cheng zich. "Maar bij UCSF, de cultuur voedt ons om dingen te doen waarvan iedereen denkt dat ze onmogelijk zijn."
Ondanks de scepsis van veel van hun collega's, Agard en Cheng - beiden professoren in de biochemie en biofysica aan de UCSF en onderzoekers van het Howard Hughes Medical Institute - erkenden dat het vangen van enkele elektronen van cruciaal belang was voor het vermogen van elektronenmicroscopen om belangrijke biologische eiwitten voldoende gedetailleerd op te lossen om wetenschappers in staat te stellen hun functie te begrijpen.
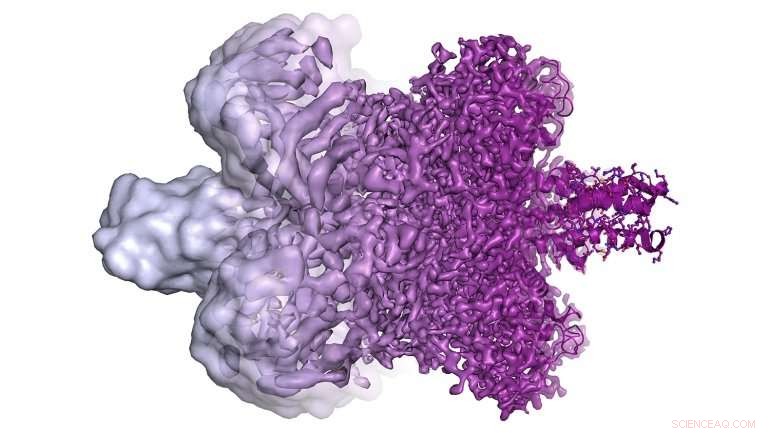
Een illustratie toont de cryo-EM-beelden die mogelijk waren vóór 2013 uiterst links en cryo-EM-beelden met een veel hogere resolutie die vandaag beschikbaar zijn aan de rechterkant. Deze afbeeldingen met hoge resolutie maken het voor onderzoekers mogelijk om moleculaire modellen te construeren van moeilijk te bestuderen eiwitten (uiterst rechts). Credit:Martin Högbom/De Koninklijke Zweedse Academie van Wetenschappen
"Het is niet alleen een kwestie van eiwitten wat duidelijker zien, Agard legde uit. "Er is een precies punt waarop je gaat van het zien van nogal nutteloze klodders naar het direct kunnen interpreteren van de structuur van een molecuul. Elektronentellende camera's zorgden echt voor een enorme sprong voorwaarts in ons vermogen om de onderliggende chemie van een eiwit te begrijpen - zowel hoe het werkt als hoe je medicijnen kunt ontwerpen die eraan binden."
Sinds hun eerste kaskraker in 2013 aantoonde dat de nieuwe camera's en software eiwitten konden oplossen in een bijna-atomaire resolutie, de technologie heeft een brede acceptatie door het veld gezien. Het heeft ook grote vooruitgang mogelijk gemaakt in het eigen onderzoek van Cheng en Agard, van het begrijpen van eiwitten die de sleutel zijn tot het gevoel van pijn, die het doelwit kunnen zijn van een nieuwe generatie geneesmiddelen, tot ontdekkingen over hoe eiwitten hun juiste vorm behouden, die grote gevolgen heeft voor kanker en ziekten zoals de ziekte van Alzheimer die worden gekenmerkt door misvormde eiwitten.
Een andere toonaangevende cryo-EM-onderzoeker bij UCSF, Adam Vorst, MD, doctoraat, die in 2014 als universitair docent bij de universiteit kwam om te profiteren van de kracht van deze nieuwe technologie, heeft geleid tot inspanningen om cryo-EM te gebruiken om te bepalen hoe nieuwe klassen geneesmiddelen op atomair niveau aan hun doeleiwitten binden.
"Cryo-EM is now allowing us to study proteins at a level of detail that would never have been possible just a few years ago, " Frost said.
Frost and Cheng have also been using cryo-EM to understand how signaling proteins on the surfaces of cells – key targets for pharmaceuticals from pain killers to cancer therapies – are influenced by the cell membranes in which they float and how proteins can bend and shape the membranes. Opmerkelijk, the ability to examine the structure of proteins in their native membranes – which had also been considered impossible by the field – was achieved for the first time in 2016 by Cheng.
The recent work with cryo-EM has been so successful that many researchers at UCSF have begun clamoring for a share of the limited microscopy time available on shared scopes. Gelukkig, with the acquisition earlier this year of new fully automated cryo-electron microscopes, including a $5 million state-of-the-art Titan Krios system funded by the Howard Hughes Medical Institute, a $6 million Titan Krios funded by an anonymous donor for the UCSF Institute of Neurodegenerative Disease – part of the UCSF Weill Institute for Neurosciences – and a $3 million Arctica system funded by the National Institutes of Health and UCSF, more and more researchers across the University and the Bay Area will be able to take their research to the next level.
Agard sees the cryo-EM revolution as closely synergistic to other burgeoning efforts on campus to completely map out the biology of disease, such as the work of Nevan Krogan, PhD, the director of UCSF's Quantitative Biosciences Institute, who is mapping the common networks of genes and proteins that drive diseases ranging from cancer to HIV to schizophrenia; and the work of Brian Shoichet, PhD, whose lab in UCSF's School of Pharmacy uses protein structures to computationally design custom drugs that fit like lock and key into target proteins.
"There is a remarkably integrated pipeline being developed at UCSF, with new technologies and approaches feeding off one another to advance our knowledge of the biology of disease at every level, " Agard said. "This is beginning to have a huge impact all around campus, but now we need to scale it up to lower barriers and speed the transition from images to therapies."
 Eenvoudige methode voor op keramiek gebaseerde flexibele elektrolytplaten voor lithium-metaalbatterijen
Eenvoudige methode voor op keramiek gebaseerde flexibele elektrolytplaten voor lithium-metaalbatterijen Hoe Mollen naar Massa in Chemie te converteren
Hoe Mollen naar Massa in Chemie te converteren  Minder duur produceren, groenere waterstofperoxide
Minder duur produceren, groenere waterstofperoxide Mysterie van faseverandering in sub-nanoseconde-octaëders structuurmotief
Mysterie van faseverandering in sub-nanoseconde-octaëders structuurmotief Hoe te weten of een stof een reductiemiddel of een oxidatiemiddel is door het periodiek systeem?
Hoe te weten of een stof een reductiemiddel of een oxidatiemiddel is door het periodiek systeem?
 Het pad van afvalwater naar putten volgen, grondwater
Het pad van afvalwater naar putten volgen, grondwater Tolwegen zijn goed voor het milieu, wetenschappers bevestigen
Tolwegen zijn goed voor het milieu, wetenschappers bevestigen NASA kijkt naar de waterdampconcentratie van orkaan Helenes
NASA kijkt naar de waterdampconcentratie van orkaan Helenes Deze mijn in Alaska kan $ 1 miljard per jaar opleveren. Is het het risico waard voor zalm?
Deze mijn in Alaska kan $ 1 miljard per jaar opleveren. Is het het risico waard voor zalm? Red de natuur om onszelf te redden, VN-rapport pleit
Red de natuur om onszelf te redden, VN-rapport pleit
Hoofdlijnen
- Schildpad die vislijn heeft ingeslikt, losgelaten in oceaan
- Kan de groei van volwassen hersencellen de manier waarop we denken over veroudering veranderen?
- Verschil tussen recombinant DNA en genetische manipulatie
- Mannelijke mammoeten vielen vaker in natuurlijke vallen en stierven, DNA-bewijs suggereert:
- Wat zijn de voordelen en nadelen van Flow Cytometry?
- Thailand verbergt grote aantallen als het gaat om zijn visvangsten in aangrenzende wateren
- Hoe een menselijke cel te maken voor een wetenschapsproject
- Behoefte aan snelheid maakt genoombewerking efficiënt, zo niet beter
- Wetenschappers tonen moleculaire basis voor mieren die als lijfwachten voor planten fungeren
- Twee van 's werelds theesoorten uitgestorven in het wild volgens nieuw rapport

- Dolfijnen slaan mensen, chimpansees bij vroege tekenen van zelfbewustzijn

- Uitgebreide quota voor blauwvintonijn kunnen het herstel ongedaan maken:wetenschappers

- Nieuwe soorten mariene spin verschijnen bij eb om wetenschappers aan Bob Marley te herinneren

- Wat gebeurt er als een kind wordt geboren met een extra chromosoom in het 23e paar?

 Wat zijn de roofdieren voor brekende schildpadden?
Wat zijn de roofdieren voor brekende schildpadden?  Verhalen vertellen kan politieke advertenties tot krachtige overtuigers maken
Verhalen vertellen kan politieke advertenties tot krachtige overtuigers maken Een andere NASA-ruimtetelescoop wordt stilgelegd in een baan om de aarde
Een andere NASA-ruimtetelescoop wordt stilgelegd in een baan om de aarde Dit bazige bureau bepaalt wanneer je opstaat en gaat zitten
Dit bazige bureau bepaalt wanneer je opstaat en gaat zitten  Uw pensioen speelt een grote rol bij het tegengaan van klimaatverandering. Zo maakt u het duurzaam
Uw pensioen speelt een grote rol bij het tegengaan van klimaatverandering. Zo maakt u het duurzaam Geavanceerde computers effent de weg naar de toekomst van NMR-spectroscopie
Geavanceerde computers effent de weg naar de toekomst van NMR-spectroscopie Snelvormende reuzen kunnen spiraalvormige protoplanetaire schijven verstoren
Snelvormende reuzen kunnen spiraalvormige protoplanetaire schijven verstoren Verwacht deze zomer weer een enorme klodder algen op Lake Erie
Verwacht deze zomer weer een enorme klodder algen op Lake Erie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

