
Wetenschap
Hoe verschillende kankercellen reageren op medicijnafgevende nanodeeltjes
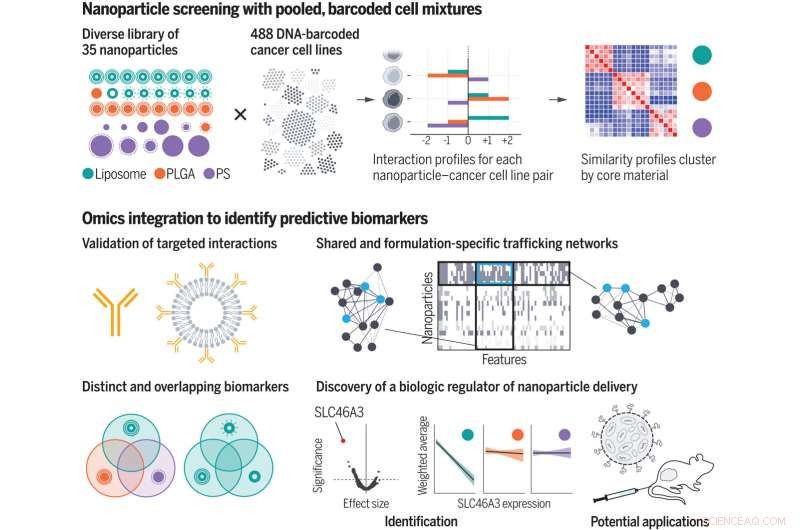
Met behulp van een samengestelde bibliotheek met nanodeeltjes screenden de onderzoekers nanodeeltjes-celinteractieprofielen van honderden kankercellen tegelijk. Door omics-annotatie op te nemen, identificeerden ze biologische kenmerken, of biomarkers, die de levering van nanodeeltjes aan cellen mediëren. Ze genereerden netwerken voor mensenhandel en ontdekten een biologische regulator van de levering van nanodeeltjes op basis van lipiden. PLGA, polylactide-co-glycolide; PS, polystyreen. Credit:Natalie Boehnke et al, Wetenschap (2022). DOI:10.1126/science.abm5551
Het gebruik van nanodeeltjes om kankermedicijnen af te leveren biedt een manier om tumoren te raken met grote doses medicijnen, terwijl de schadelijke bijwerkingen die vaak gepaard gaan met chemotherapie worden vermeden. Tot nu toe zijn echter slechts een handvol op nanodeeltjes gebaseerde kankergeneesmiddelen door de FDA goedgekeurd.
Een nieuwe studie van MIT en Broad Institute of MIT en Harvard-onderzoekers kan helpen om enkele van de obstakels voor de ontwikkeling van op nanodeeltjes gebaseerde medicijnen te overwinnen. De analyse van het team van de interacties tussen 35 verschillende soorten nanodeeltjes en bijna 500 soorten kankercellen onthulde duizenden biologische eigenschappen die beïnvloeden of die cellen verschillende soorten nanodeeltjes opnemen.
De bevindingen kunnen onderzoekers helpen hun medicijnafgiftedeeltjes beter af te stemmen op specifieke soorten kanker, of nieuwe deeltjes te ontwerpen die profiteren van de biologische kenmerken van bepaalde soorten kankercellen.
"We zijn enthousiast over onze bevindingen omdat het eigenlijk nog maar het begin is - we kunnen deze benadering gebruiken om in kaart te brengen welke soorten nanodeeltjes het beste zijn om bepaalde celtypen aan te pakken, van kanker tot immuuncellen en andere soorten gezonde en zieke orgaancellen. We leren hoe oppervlaktechemie en andere materiaaleigenschappen een rol spelen bij targeting", zegt Paula Hammond, professor aan het MIT Institute, hoofd van de afdeling Chemical Engineering en lid van MIT's Koch Institute for Integrative Cancer Research.
Hammond is de hoofdauteur van de nieuwe studie, die verschijnt in Science . De hoofdauteurs van het artikel zijn Natalie Boehnke, een MIT-postdoc die binnenkort zal toetreden tot de faculteit van de Universiteit van Minnesota, en Joelle Straehla, de Charles W. en Jennifer C. Johnson Clinical Investigator aan het Koch Institute, een instructeur aan de Harvard Medical School, en een kinderoncoloog bij het Dana-Farber Cancer Institute.
Cel-deeltje interacties
Het laboratorium van Hammond heeft eerder vele soorten nanodeeltjes ontwikkeld die kunnen worden gebruikt om medicijnen aan cellen te leveren. Studies in haar lab en anderen hebben aangetoond dat verschillende soorten kankercellen vaak verschillend reageren op dezelfde nanodeeltjes. Boehnke, die eierstokkanker bestudeerde toen ze bij Hammond's lab kwam, en Straehla, die hersenkanker bestudeerde, merkten dit fenomeen ook op in hun studies.
De onderzoekers veronderstelden dat biologische verschillen tussen cellen de variatie in hun reacties zouden kunnen veroorzaken. Om erachter te komen wat die verschillen zouden kunnen zijn, besloten ze een grootschalig onderzoek te doen waarin ze konden kijken naar een groot aantal verschillende cellen die in wisselwerking staan met vele soorten nanodeeltjes.
Straehla had onlangs kennis genomen van het PRISM-platform van het Broad Institute, dat was ontworpen om onderzoekers in staat te stellen snel duizenden medicijnen op honderden verschillende soorten kanker tegelijk te screenen. Met instrumentele samenwerking van Angela Koehler, een universitair hoofddocent biologische engineering aan het MIT, besloot het team te proberen dat platform aan te passen om cel-nanodeeltjes-interacties te screenen in plaats van cel-geneesmiddel-interacties.
"Met deze aanpak kunnen we gaan nadenken of er iets is aan de genotypische signatuur van een cel dat voorspelt hoeveel nanodeeltjes het zal opnemen", zegt Boehnke.
Voor hun screening gebruikten de onderzoekers 488 kankercellijnen uit 22 verschillende weefsels van oorsprong. Elk celtype is "gebarcodeerd" met een unieke DNA-sequentie waarmee onderzoekers de cellen later kunnen identificeren. Voor elk celtype zijn ook uitgebreide datasets beschikbaar over hun genexpressieprofielen en andere biologische kenmerken.
Aan de kant van de nanodeeltjes creëerden de onderzoekers 35 deeltjes, die elk een kern hadden die bestond uit liposomen (deeltjes gemaakt van veel vetmoleculen die lipiden worden genoemd), een polymeer dat bekend staat als PLGA, of een ander polymeer dat polystyreen wordt genoemd. De onderzoekers bedekten de deeltjes ook met verschillende soorten beschermende of doelgerichte moleculen, waaronder polymeren zoals polyethyleenglycol, antilichamen en polysachariden. Hierdoor konden ze de invloed van zowel de kernsamenstelling als de oppervlaktechemie van de deeltjes bestuderen.
In samenwerking met wetenschappers van het Broad Institute, waaronder Jennifer Roth, directeur van het PRISM-lab, stelden de onderzoekers pools van honderden verschillende cellen bloot aan een van de 35 verschillende nanodeeltjes. Elk nanodeeltje had een fluorescerende tag, dus de onderzoekers konden een celsorteertechniek gebruiken om de cellen te scheiden op basis van hoeveel fluorescentie ze afgaven na een blootstelling van vier of 24 uur.
Op basis van deze metingen kreeg elke cellijn een score toegewezen die de affiniteit voor elk nanodeeltje vertegenwoordigt. De onderzoekers gebruikten vervolgens machine learning-algoritmen om die scores te analyseren, samen met alle andere biologische gegevens die voor elke cellijn beschikbaar waren.
Deze analyse leverde duizenden kenmerken, of biomarkers, op die verband houden met affiniteit voor verschillende soorten nanodeeltjes. Veel van deze markers waren genen die coderen voor de cellulaire machinerie die nodig is om deeltjes te binden, ze in een cel te brengen of ze te verwerken. Van sommige van deze genen was al bekend dat ze betrokken zijn bij de handel in nanodeeltjes, maar vele andere waren nieuw.
"We hebben enkele markers gevonden die we verwachtten, en we hebben ook veel meer gevonden dat echt onontgonnen is. We hopen dat andere mensen deze dataset kunnen gebruiken om hun kijk op de interactie tussen nanodeeltjes en cellen te vergroten", zegt Straehla.
Opname van deeltjes
De onderzoekers kozen een van de biomarkers die ze identificeerden, een eiwit genaamd SLC46A3, voor verder onderzoek. Het PRISM-scherm had aangetoond dat hoge niveaus van dit eiwit correleerden met een zeer lage opname van op lipiden gebaseerde nanodeeltjes. Toen de onderzoekers deze deeltjes testten in muismodellen van melanoom, vonden ze dezelfde correlatie. De bevindingen suggereren dat deze biomarker kan worden gebruikt om artsen te helpen bij het identificeren van patiënten van wie de tumoren eerder reageren op op nanodeeltjes gebaseerde therapieën.
Nu proberen de onderzoekers het mechanisme bloot te leggen van hoe SLC46A3 de opname van nanodeeltjes reguleert. Als ze nieuwe manieren zouden kunnen ontdekken om de cellulaire niveaus van dit eiwit te verlagen, zou dat kunnen helpen tumoren vatbaarder te maken voor medicijnen die worden gedragen door lipidenanodeeltjes. De onderzoekers werken ook aan het verder onderzoeken van enkele van de andere biomarkers die ze hebben gevonden.
Deze screeningsaanpak zou ook kunnen worden gebruikt om veel andere soorten nanodeeltjes te onderzoeken waar de onderzoekers in dit onderzoek niet naar hebben gekeken.
"The sky is the limit in termen van wat andere onontdekte biomarkers zijn die we gewoon niet hebben vastgelegd omdat we ze niet hebben gescreend", zegt Boehnke. "Hopelijk is het een inspiratie voor anderen om op een vergelijkbare manier naar hun nanodeeltjessystemen te kijken." + Verder verkennen
Ingenieurs ontwikkelen nanodeeltjes die de bloed-hersenbarrière passeren
Dit verhaal is opnieuw gepubliceerd met dank aan MIT News (web.mit.edu/newsoffice/), een populaire site met nieuws over MIT-onderzoek, innovatie en onderwijs.
 Onderzoekers bedenken kleine, hersluitbare pakketten om materialen op tijd af te leveren
Onderzoekers bedenken kleine, hersluitbare pakketten om materialen op tijd af te leveren Baanbrekend onderzoek maakt kindervaccins veilig bij alle temperaturen
Baanbrekend onderzoek maakt kindervaccins veilig bij alle temperaturen Waarom toekomstige huizen gemaakt kunnen worden van levende schimmel
Waarom toekomstige huizen gemaakt kunnen worden van levende schimmel Antivries om vliegtuigen te verbeteren, ijs en orgaantransplantaties
Antivries om vliegtuigen te verbeteren, ijs en orgaantransplantaties What Is Vermiculite?
What Is Vermiculite?
Hoofdlijnen
- Wat is het voordeel van het feit dat het DNA goed is ingepakt in de chromosomen?
- Exon: definitie, functie en belang in RNA Splicing
- Genieten criminele psychopaten van de angst van andere mensen?
- Een nieuwe studie heeft geconcludeerd dat er geen duidelijk bewijs is dat COVID-19 werd overgedragen door vleermuizen
- San Diego Zoo pinguïn voorzien van orthopedisch schoeisel (update)
- Wetenschappers ontdekken methode om voedselverspilling om te zetten in biobrandstoffen
- Op bewijs gebaseerde tips om uw geheugen te verbeteren
- Kankerwetenschappers ruiken de genen achter Durians Famous Stink
- Onderzoekers modelleren voordelen van bosherstel aan rivieroevers
- Nieuwe antennetechnologie om keramische coatings uit te rusten met warmtestralingsregeling

- Een mini Mona Lisa maken

- Ingenieurs sandwichen atomaire lagen om nieuwe materialen te maken voor energieopslag

- Onderzoekers observeren structurele transformaties in enkele nanokristallen

- Prototype apparaat voor het meten van op grafeen gebaseerde elektromagnetische straling
 Om de politie te ontlasten, moet je begrijpen welke rol de politie speelt in onze samenleving
Om de politie te ontlasten, moet je begrijpen welke rol de politie speelt in onze samenleving Trucs van het vak - hoe gelikte websites en apps lenen gemakkelijk maken
Trucs van het vak - hoe gelikte websites en apps lenen gemakkelijk maken Nieuwe wegen inslaan in orkaanmodellering
Nieuwe wegen inslaan in orkaanmodellering Hoe de doorlaatbaarheid te berekenen
Hoe de doorlaatbaarheid te berekenen Synthetische chemicaliën:genegeerde agenten van wereldwijde verandering
Synthetische chemicaliën:genegeerde agenten van wereldwijde verandering Zelf-geassembleerde nanotexturen creëren een antireflecterend oppervlak op siliciumzonnecellen
Zelf-geassembleerde nanotexturen creëren een antireflecterend oppervlak op siliciumzonnecellen Hoe onze economie de pandemie kan overleven
Hoe onze economie de pandemie kan overleven VS zou de overname van Qualcomm door Broadcoms kunnen blokkeren, ambtenaren waarschuwen
VS zou de overname van Qualcomm door Broadcoms kunnen blokkeren, ambtenaren waarschuwen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

