
Wetenschap
Nieuwste Cornell-stip heeft een nieuw kankerwapen:antilichamen
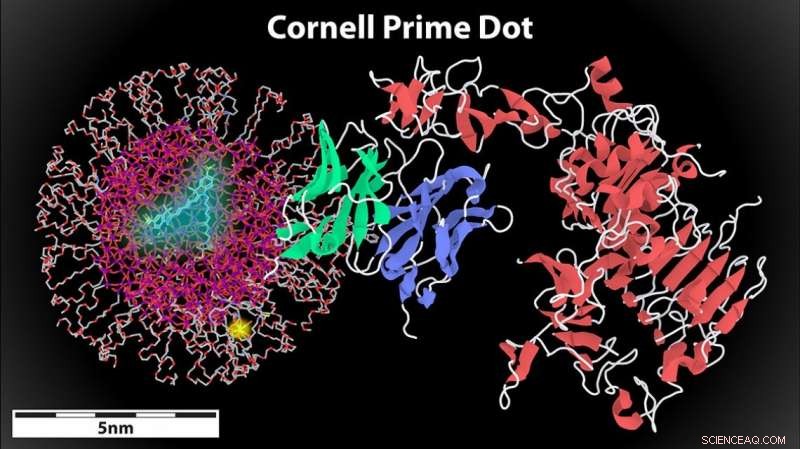
Een weergave van de Cornell-prime-stip (links) met een aangehecht antilichaamfragment (midden) dat bindt aan een HER2-kankercelreceptor (rechts). De combinatie van de punt en het antilichaam hebben een diameter van minder dan 8 nanometer, de limiet voor renale klaring. Krediet:Cornell University
Op antilichamen gebaseerde beeldvorming van een bijzonder agressieve vorm van borstkanker wordt wereldwijd klinisch onderzocht, maar de weg van proef naar toepassing wordt belemmerd door een groot obstakel:veiligheid.
Bezorgdheid komt voort uit inefficiënte tumortargeting, wat kan leiden tot ophoping in het beenmerg, lever en nieren van het radioactieve materiaal dat nodig is voor de beeldvorming. Recente inspanningen waren gericht op leveringsvoertuigen op nanoschaal met immuuncomponenten, maar deze vehikels zijn vaak nog te groot (20 nanometer of groter) voor renale klaring na beeldvorming.
Ulrich Wiesner, de Spencer T. Olin Professor of Engineering in materiaalkunde en engineering aan de Cornell University, in samenwerking met Dr. Michelle Bradbury van Memorial Sloan Kettering Cancer Center (MSKCC) en Weill Cornell Medicine, heeft een nieuwe benadering voorgesteld met behulp van ultrakleine silica-nanodeeltjes - beter bekend als "Cornell-dots" (of C-dots) - die meer dan twaalf jaar geleden in zijn laboratorium zijn uitgevonden.
Hun team, waaronder onderzoekers van het farmaceutische bedrijf MedImmune, hebben de C-dots uitgerust met antilichaamfragmenten. Omdat de resulterende conjugaten kleiner zijn dan 8 nanometer, deze C-dots zorgen voor renale klaring terwijl de specificiteit wordt bereikt die nodig is voor efficiënte tumortargeting.
Ze rapporteren hun ontdekking in "Ultrasmall Targeted Nanoparticles with Engineered Antibody Fragments for Imaging Detection of HER2-Overexpressing Breast Cancer, " gepubliceerd op 8 oktober in Natuurcommunicatie . Feng Chen, senior onderzoeker bij MSKCC, en Kai-Ma, postdoctoraal onderzoeker in het Wiesner-lab, zijn co-hoofdauteurs.
Wiesner zei dat dit onderzoek "een geheel nieuwe landingsbaan" creëert om antilichaamfragmenten te gebruiken voor een aantal ziekten, kanker in het bijzonder, en voor zowel diagnostiek als medicijnafgifte - wanneer gecombineerd in een enkele entiteit die ook wel 'theranostics' wordt genoemd.
"Dit is de eerste keer dat we met deze antilichaamfragmenten hebben gewerkt, ' zei Wiesner, "waardoor de kracht van antilichamen wordt benut in de strijd tegen kanker."
Cornell-punten en hun nieuwere generatie, de zogenaamde "Cornell-prime-punten, " of gewoon C'-dots - zijn geëvolueerd sinds Wiesner en zijn groep ze in 2005 introduceerden en sindsdien, in samenwerking met Bradbury, een eerste klinische proef achtte ze veilig voor mensen in 2014. Twee jaar geleden, de stippen bleken niet alleen het vermogen te hebben om kankercellen te detecteren, maar ook om zelftherapeutisch te zijn, waardoor ze daadwerkelijk werden gedood.
Dit laatste onderzoek plaatst C-dots weer in de rol van kankerzoeker, maar voegt een "tumorzoeker" toe in de vorm van een antilichaamfragment. Ze gebruikten een bepaald fragment van het Y-vormige antilichaam, in tegenstelling tot het hele molecuul, om de C'-dot binnen de groottedrempel voor renale klaring te houden.
Het doelwit:HER2-positieve borstkanker, agressiever en dodelijker dan HER2-negatieve kanker, waardoor het een aantrekkelijk doelwit is voor nieuwe diagnostiek en therapieën. In de samenwerking, MedImmune heeft een antilichaamfragment ontwikkeld dat specifiek gericht is op het HER2-eiwit en een conjugatieplaats die de bindingsactiviteit niet verstoort. De groepen van Wiesner en Bradbury, In de tussentijd, werkten samen om het aan het C'-puntoppervlak te bevestigen om het totale conjugaat onder de 8 nanometer in diameter te houden.
De stip zelf werd gesynthetiseerd op een manier die hem vijf verschillende functies gaf, allemaal binnen zijn ultrakleine grootte van 6 tot 7 nanometer.
Zowel in vitro als in vivo (muis) targeting van HER2-positieve borstkankercellen was succesvol, met in vivo tumoropname van de geïnjecteerde stippen tot wel 17,2 procent, de hoogste die Wiesner en Bradbury hebben behaald in al hun C-dot-onderzoek.
"De injectie circuleert door het bloed en moet uit het vaatstelsel ontsnappen, door het bindweefsel moet diffunderen, moet associëren met de tumor en dan een beetje het tumorlichaam binnendringen, " zei Wiesner. "We willen 100 procent - iedereen wil 100 procent. Maar als je kijkt naar alle andere dingen die elders in de carrosserie om het voertuig strijden, 17 procent is niet zo klein."
Bradbury, die samen met Wiesner het MSK-Cornell Center for Translation of Cancer Nanomedicines leidt, noemt de C'-dot een 'game-changer' in op nanodeeltjes gebaseerde medicijnafgifte.
"Deze onderzoeksresultaten zijn erg opwindend, " ze zei, "zoals ze suggereren dat we specifiek een verscheidenheid aan therapieën met kleine moleculen zouden kunnen leveren - chemotherapie, remmers en radiotherapie - zonder de toxiciteit die gewoonlijk wordt gevonden met grotere deeltjessondes."
 Induced-fit adsorbens voor acetyleen
Induced-fit adsorbens voor acetyleen Over het hele spectrum:onderzoekers vinden een manier om de kleur van licht in materiaal van de volgende generatie te stabiliseren
Over het hele spectrum:onderzoekers vinden een manier om de kleur van licht in materiaal van de volgende generatie te stabiliseren Nuttige microben inhaleren koolstofdioxide via een poreuze cilindrische elektrode en scheiden nuttige chemicaliën uit
Nuttige microben inhaleren koolstofdioxide via een poreuze cilindrische elektrode en scheiden nuttige chemicaliën uit Hoe maak je een Herkimer-diamant schoon?
Hoe maak je een Herkimer-diamant schoon?
Herkimer-diamanten zijn eigenlijk zeldzame kristallen die alleen te vinden zijn in Herkimer County, New York. De stenen zijn dubbel beëindigde kwartskristallen die ruitvormig zijn en in totaal 18 facetten he
 Een nieuwe methode voor kwantitatieve schatting van de mate van overeenkomst van coördinatieveelvlakken
Een nieuwe methode voor kwantitatieve schatting van de mate van overeenkomst van coördinatieveelvlakken
 Hawaii stelt verbod op bepaalde zonnebrandmiddelen voor om koraalriffen te redden
Hawaii stelt verbod op bepaalde zonnebrandmiddelen voor om koraalriffen te redden  2015-2016 El Nino veroorzaakte ziekte-uitbraken over de hele wereld
2015-2016 El Nino veroorzaakte ziekte-uitbraken over de hele wereld Horseshoe Crab Science Project
Horseshoe Crab Science Project  Hoe energie-intensieve economieën kunnen overleven en bloeien terwijl de wereld klimaatactie opvoert
Hoe energie-intensieve economieën kunnen overleven en bloeien terwijl de wereld klimaatactie opvoert S.Africa kolengordel tussen 's werelds hotspots voor vervuiling:Greenpeace
S.Africa kolengordel tussen 's werelds hotspots voor vervuiling:Greenpeace
Hoofdlijnen
- Wat zijn enkele voor- en nadelen van het gebruik van DNA-analyse om wetshandhaving bij misdrijven te ondersteunen?
- Wat is een interne regulator van de celcyclus?
- Vertaling (biologie): definitie, stappen, diagram
- Wat veroorzaakt het uitsterven van planten en dieren?
- Malawi wendt zich tot Britse troepen in stropersoorlog
- Wat zijn de functies van co-enzymen?
- De levenscyclus van Gymnosperms
- Verschrikkelijke sneeuwman? Nee - studie koppelt DNA-monsters van vermeende Yeti's aan Aziatische beren
- Archaea: Structure, Characteristics & Domain
- Een sprenkel van platina-nanodeeltjes op grafeen maakt hersensondes gevoeliger
- Verbetering van de energie-efficiëntie van 2D-materiaalelektronica met behulp van topologisch halfmetaal

- Onze elektromagnetische vervuiling tegengaan:MXene kan mobiele apparaten beschermen tegen elektromagnetische interferentie
- Vormgecodeerde dynamische assemblage van mobiele micromachines

- Nanodeeltjes met een schaalstructuur verbeteren de prestaties van zinkoxide-fotodetectoren

 Vierkante voet naar kubieke voet omzetten
Vierkante voet naar kubieke voet omzetten  Hoe kometen om de zon draaien?
Hoe kometen om de zon draaien?  Realtime beeldvorming laat zien hoe SARS-CoV-2 menselijke cellen aanvalt
Realtime beeldvorming laat zien hoe SARS-CoV-2 menselijke cellen aanvalt Natuurkundigen onderzoeken nieuwe klasse van resonatoren
Natuurkundigen onderzoeken nieuwe klasse van resonatoren Een traumatisch verleden kan je een betere maatschappelijk werker maken, maar het kan je in de eerste plaats blokkeren om het te bestuderen
Een traumatisch verleden kan je een betere maatschappelijk werker maken, maar het kan je in de eerste plaats blokkeren om het te bestuderen Verband gevonden tussen moorden op ongewapende zwarte mensen door politie en te vroeg geboren baby's
Verband gevonden tussen moorden op ongewapende zwarte mensen door politie en te vroeg geboren baby's Studie vindt sterke steun voor bescherming van de oceaan
Studie vindt sterke steun voor bescherming van de oceaan RoboTurk:een crowdsourcingplatform voor imitatieleren in robotica
RoboTurk:een crowdsourcingplatform voor imitatieleren in robotica
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

