
Wetenschap
Nieuw hulpmiddel om circulerende kankercellen te volgen
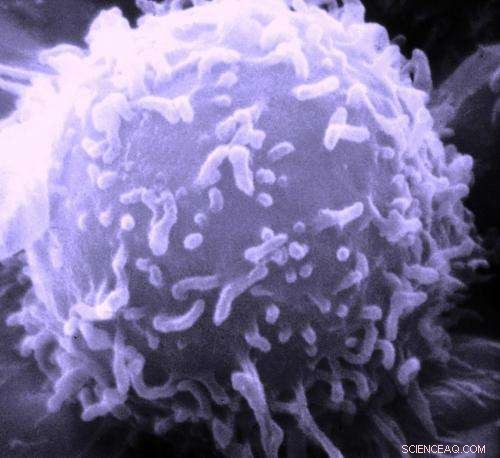
Elektronenmicroscopisch beeld van een enkele menselijke lymfocyt. Krediet:Dr. Triche National Cancer Institute
Van kankertumoren is bekend dat ze cellen in de bloedbaan afgeven, en het zijn deze circulerende tumorcellen of CTC's die de bronnen zijn van uitgezaaide tumoren - tumoren die zich verspreiden en zich vormen op verre locaties in het lichaam. In feite, de meeste patiënten die aan kanker bezwijken, sterven niet vanwege de aanvankelijke tumoren die zich vormen, maar eerder vanwege de dodelijke secundaire uitgezaaide tumoren die op verre locaties verschijnen. Als resultaat, het begrijpen van de biologie en klinische relevantie van deze reizende cellen is van cruciaal belang in onze strijd tegen kanker.
Monitoring van circulerende tumorcellen, echter, is een enorme uitdaging omdat ze in het bloed worden overtroffen door gezonde cellen met een niveau van meer dan 1 miljard-op-1. Bovendien, ze kunnen gevarieerde en dynamische eigenschappen vertonen, en de verzameling van CTC's die in de bloedbaan van een kankerpatiënt worden gevonden, kan een verschillend metastatisch potentieel hebben. Bijgevolg, inspanningen om de analyse van deze cellen in de reguliere klinische geneeskunde te integreren, zijn beperkt gebleven omdat het moeilijk was om vast te stellen op welke soorten cellen en op welke fenotypische eigenschappen zou moeten worden getarget. Maar het potentieel van CTC's om de verzameling van een niet-invasieve "vloeibare biopsie" mogelijk te maken om de progressie van kanker te volgen, is een verleidelijke mogelijkheid die aanzienlijke aandacht voor dit probleem is blijven trekken.
Een doorbraak van de onderzoeksgroep van professor Shana Kelley aan de Universiteit van Toronto, gepubliceerd in: Natuur Nanotechnologie biedt een nieuw hulpmiddel om CTC's te karakteriseren die kankerbiologen en clinici kunnen helpen begrijpen hoe deze cellen kunnen worden gebruikt om een betere behandeling te bieden. Met behulp van magnetische nanodeeltjes, CTC's in bloedmonsters waren gericht op basis van eiwitten die op het celoppervlak werden weergegeven, en gescheiden op basis van de niveaus van het aanwezige eiwit. Met behulp van een microfluïdisch apparaat met hoge resolutie, cellen worden vervolgens gescheiden in 100 verschillende vangzones om een profiel te genereren dat fenotypische informatie biedt met betrekking tot metastatisch potentieel. Met behulp van deze benadering en het volgen van cellen die zijn gegenereerd in diermodellen van kanker en in monsters die zijn verzameld bij prostaatkankerpatiënten, de eigenschappen van CTC's bleken te evolueren en agressiever te worden naarmate tumoren geavanceerder werden.
“Door deze aanpak we wilden een nieuwe manier bieden om CTC's te profileren die verder gaan dan alleen het tellen van hun aantal in klinische monsters, " verklaarde Dr. Mahla Poudineh, hoofdstudent auteur op het papier. "In plaats daarvan, we wilden fentotypische informatie verstrekken waarmee deze cellen als goedaardig of gevaarlijker kunnen worden geclassificeerd, wat dan de behandelingsopties zou informeren."
"We hadden het geluk om samen te werken met een aantal oncologen van het Sunnybrook Research Center en het Princess Margaret Hospital terwijl we deze technologie ontwikkelden, zodat we onze aanpak konden testen met monsters van echte patiënten en beter konden begrijpen hoe we deze konden aanpassen voor gebruik in de kliniek, " merkte Dr. Kelley op.
De Kelley-groep (www.kelleylaboratory.com/), samen met medewerkers in de Sargent-groep (www.light.utoronto.ca/) aan de Universiteit van Toronto, hopen de door hen gerapporteerde aanpak om te zetten in een apparaat dat kan worden gebruikt door kankeronderzoekers en uiteindelijk clinici om CTC-analyse routinematig te controleren en te gebruiken om de progressie van kanker te beperken.
 Kunstmatige fotosynthesetechnologie in opkomst
Kunstmatige fotosynthesetechnologie in opkomst Welke elementen maken bakpoeder
Welke elementen maken bakpoeder  We hebben een manier ontdekt om DNA van vingerafdrukken te herstellen zonder ze te vernietigen
We hebben een manier ontdekt om DNA van vingerafdrukken te herstellen zonder ze te vernietigen Licht schijnend op de dynamiek van de aangeslagen toestand in perovskietmaterialen
Licht schijnend op de dynamiek van de aangeslagen toestand in perovskietmaterialen Nieuwe katalysator maakt weg vrij voor koolstofneutrale brandstof
Nieuwe katalysator maakt weg vrij voor koolstofneutrale brandstof
 De meeste Black Friday-aankopen eindigen al snel als afval
De meeste Black Friday-aankopen eindigen al snel als afval Hulpprogramma's gebruikt door een Herpetologist
Hulpprogramma's gebruikt door een Herpetologist Wetenschappers waarschuwen dat nieuwe president van Brazilië regenwoud kan verstikken
Wetenschappers waarschuwen dat nieuwe president van Brazilië regenwoud kan verstikken Rapport vindt verbeteringen in de algehele gezondheid van Chesapeake Bays
Rapport vindt verbeteringen in de algehele gezondheid van Chesapeake Bays 'S Werelds eerste dieren veroorzaakten opwarming van de aarde
'S Werelds eerste dieren veroorzaakten opwarming van de aarde
Hoofdlijnen
- Routes uit isolatie voor Yellowstone grizzlyberen
- VS keuren herstelplan voor Mexicaanse wolven goed
- Wat zijn klaprozen?
- Hoe spoor je een geheimzinnige havik op? Volg de isotopen
- Hoe Dopamine werkt
- Alfred Russel Wallace: Biography, Theory of Evolution & Facts
- Wat zijn de drie belangrijkste verschillen tussen een plantencel en een dierlijke cel?
- Kleine bijen spelen een grote rol in het geheime seksleven van bomen
- Kenia mannelijke leeuwen gezien in intieme daad; binding, deskundigen zeggen
- Een nieuwe manier om naar de innerlijke werking van kleine magneten te kijken

- Op grafeen gebaseerde terahertz-absorbers

- DNAzymes en gouden nanodeeltjes:een colorimetrische test voor diagnostiek in het veld
- Video:Nanobots:de opkomst van de moleculaire machines
- Kanker kan nauwkeurig worden gediagnosticeerd met behulp van een urinetest met kunstmatige intelligentie
 Onderzoekers beantwoorden belangrijke vraag over elektronentoestanden
Onderzoekers beantwoorden belangrijke vraag over elektronentoestanden Norwegian Air ontslaat helft personeel vanwege virus reisverbod
Norwegian Air ontslaat helft personeel vanwege virus reisverbod Morphing origami krijgt een nieuwe vorm, uitbreiding van gebruiksmogelijkheden
Morphing origami krijgt een nieuwe vorm, uitbreiding van gebruiksmogelijkheden Onderzoek toont potentieel schadelijke arseenniveaus aan bij populaire voormalige mijnbouwwerken
Onderzoek toont potentieel schadelijke arseenniveaus aan bij populaire voormalige mijnbouwwerken Cataclysmische variabele ES Ceti heeft een accretieschijf, studie suggereert:
Cataclysmische variabele ES Ceti heeft een accretieschijf, studie suggereert: bijna 400, 000 ontvluchten de stad DR Congo vanwege de angst dat de vulkaan opnieuw zou kunnen uitbarsten
bijna 400, 000 ontvluchten de stad DR Congo vanwege de angst dat de vulkaan opnieuw zou kunnen uitbarsten Wat is het verschil tussen een Centriole en een Centrosome?
Wat is het verschil tussen een Centriole en een Centrosome?  Wat is augmented reality, hoe dan ook?
Wat is augmented reality, hoe dan ook?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

