
Wetenschap
Zelfmontage van gelaagde membranen

Fig. 1. Schematische weergave van een zak ingesloten in een membraan met drie zones, gevormd als een druppel HA in oplossing in een PA-oplossing valt. De binnenste laag (1) is een gel van HA-moleculen. Het is omgeven door een laag nanovezels die tangentieel aan het oppervlak van de zak liggen (2), waaruit loodrecht nanovezels tevoorschijn komen (3).
Technieken voor het maken van complexe nanogestructureerde materialen door zelfassemblage van moleculen zijn steeds geavanceerder geworden. Maar het was problematisch om deze technieken naar het biologische rijk te brengen. Onlangs, wetenschappers van de Northwestern University gebruikten zelfassemblage onder gecontroleerde omstandigheden om een membraan te creëren dat bestaat uit lagen met duidelijk verschillende structuren. Nutsvoorzieningen, werken bij de Advanced Photon Source (APS) van het Amerikaanse ministerie van Energie, het team gebruikte kleine hoek röntgenverstrooiing (SAXS) om deze structuren beter te bepalen en te bestuderen hoe ze zich vormen. Deze nieuwe informatie maakt de weg vrij voor ontwerp en synthese van hiërarchische structuren met biomedische toepassingen.
Peptide-amfifielen (PA) zijn ketens van aminozuren die zijn getipt met andere moleculen, zodat het ene uiteinde hydrofiel is (goed mengt met water) en het andere hydrofoob (niet dol op water). In waterige oplossing, PA's vormen lang, dunne nanovezels als de aminozuurketens binden aan aangrenzende ketens om β-sheets te vormen. De wetenschappers van de Northwestern University hadden eerder ontdekt dat wanneer een waterige oplossing met positief geladen PA's in contact werd gebracht met een waterige oplossing van negatief geladen hyaluronzuur (HA - een groot biologisch molecuul dat voorkomt in bindweefsel en andere weefsels), een dichte, vezelige laag gevormd binnen milliseconden, het creëren van een barrière die ervoor zorgde dat de twee oplossingen niet vermengden.
Preciezer, de onderzoekers ontdekten dat de vezellaag voorkomt dat geaggregeerde PA's naar de HA-kant migreren, maar laat HA-moleculen zichzelf langzaam door de barrière naar de PA-kant dringen, op een tijdschaal van minuten of langer.
Het resultaat was een membraanstructuur met drie zones:een gelachtige laag aan de HA-zijde, een vezelige mat bestaande uit PA-nanovezels die in het vlak van het grensvlak tussen de oplossingen liggen, en een coating van vezels die loodrecht van het grensvlak af is gericht en gevormd door elektrostatisch gebonden complexen van PA en HA (Fig. 1).
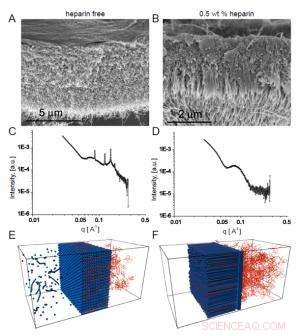
Fig. 2. Scanning-elektronenmicrofoto's tonen het homogene membraan dat zich vormt in afwezigheid van heparine (A), terwijl in aanwezigheid van heparine een vezelachtige structuur dwars op het membraan (B) wordt gevormd.
De interesse van het team in deze membranen hing af van mogelijke biomedische toepassingen waarbij de peptidesequentie die de nanovezels vormt een gekozen biologische activiteit zou hebben. In een voorbeeld, ze hebben een heparine-bindende sequentie ingebouwd om angiogenese (de vorming van nieuwe bloedvaten) te bevorderen, zodat het membraan kan helpen bij weefselherstel. Om de structuur met drie zones te vormen, de onderzoekers vonden dat de HA-oplossing heparine in een bepaald concentratiebereik moest bevatten. Scanning-elektronenmicroscopie toonde duidelijk een lineaire structuur die het membraan kruiste dat zich vormde toen heparine aanwezig was met 0, 5 gew.% (figuur 2a), in tegenstelling tot het meer homogene uiterlijk van het membraan gecreëerd in afwezigheid van heparine (figuur 2b).
De wetenschappers wendden zich tot SAXS bij de DuPont-Northwestern-Dow Collaborative Access Team beamline 5-ID-D bij de Argonne APS, een Office of Science gebruikersfaciliteit. Deze studies geven inzicht in de precieze structuur van de driezonemembranen en een beter begrip van de dynamiek van hun vorming.
De heparinevrije membranen produceerden goed gedefinieerde Bragg-pieken, terwijl de driezonemembranen dat niet deden. Bovendien, membranen die ontstonden in aanwezigheid van kleinere heparineconcentraties vertoonden grotere Bragg-pieken dan die geproduceerd wanneer de heparineconcentratie hoger was, wat wijst op een competitie tussen twee structuren waarvan de uitkomst afhing van heparineniveaus.
Een tijdreeks van SAXS-metingen op een heparinevrij experiment toonde aan dat de Bragg-pieken zich begonnen te vormen een paar minuten nadat de twee oplossingen met elkaar in contact waren gebracht, en bereikte na ongeveer 45 minuten op volle sterkte.
Interpretatie van de SAXS-bevindingen in het licht van hun eerdere experimenten en de bekende eigenschappen van PA's en HA, de wetenschappers verklaren de verschillen tussen de twee soorten membraan als het resultaat van verschillende soorten aggregatie. Bij afwezigheid van heparine, de PA en HA komen samen in nanosferische aggregaten die zich in een kubische opstelling samenpakken, over een periode van enkele tientallen minuten, om een membraan te vormen dat goed gedefinieerde Bragg-pieken genereert.
Wanneer heparine aanwezig is, daarentegen, het bindt sterk met de PA en verandert de interactie met AH-moleculen. In dit geval, een barrière van nanovezels die evenwijdig aan de interface van de oplossing ligt, vormt zich onmiddellijk, fungeert dan als een diffusiebarrière waar HA langzaam doorheen gaat. Zoals het aan de andere kant naar voren komt, het bindt aan PA om nanovezels te vormen die loodrecht op het grensvlak groeien. Deze geordende nanovezelarray produceert geen Bragg-pieken.
Het toegenomen begrip en de controle van deze processen die voortkomen uit dit onderzoek zou het mogelijk kunnen maken om bioactieve membranen te bouwen met een verscheidenheid aan structuren en doeleinden.
 Verdere kennis nodig over de verschillen tussen melkeiwitten
Verdere kennis nodig over de verschillen tussen melkeiwitten Een methode om kristallen te construeren met een grote fractie reactieve facetten
Een methode om kristallen te construeren met een grote fractie reactieve facetten Afluisteren van afzonderlijke moleculen met licht door het gebabbel opnieuw af te spelen
Afluisteren van afzonderlijke moleculen met licht door het gebabbel opnieuw af te spelen Nieuwe carbon dot-gebaseerde methode om de efficiëntie van zonnecellen en leds te verhogen
Nieuwe carbon dot-gebaseerde methode om de efficiëntie van zonnecellen en leds te verhogen Wat zijn de toepassingen van Tungsten?
Wat zijn de toepassingen van Tungsten?
 Wetenschappers ontdekken dat de foutbron van een zee-ijsmodel varieert met het seizoen
Wetenschappers ontdekken dat de foutbron van een zee-ijsmodel varieert met het seizoen Wat is het oudste fossiel dat ooit is gevonden?
Wat is het oudste fossiel dat ooit is gevonden?  NASA schat zware regenval in Texas en Louisiana door het golfweersysteem
NASA schat zware regenval in Texas en Louisiana door het golfweersysteem Ecoloog vindt optimisme in bossen in Alaska
Ecoloog vindt optimisme in bossen in Alaska Extreem weer om stedelijke elektriciteitsnetten te overbelasten, studie toont
Extreem weer om stedelijke elektriciteitsnetten te overbelasten, studie toont
Hoofdlijnen
- Septate vs. Non-Septate Hyphae
- Wandelstranden, vrijwilligers verzamelen gegevens over dode zeevogels
- Wat zijn emoties,
- Genoomanalyse van vroege plantenafstamming werpt licht op hoe planten leerden te gedijen op het land
- Diabetesmedicijn helpt bij het repareren van UV-beschadigd DNA in cellen van maankinderen
- Ontdekking van circadiane klokken kan de waterefficiëntie in voedselplanten helpen verhogen
- De rol van Taq-polymerase in PCR
- Je wandeling is zo duidelijk dat het diepe persoonlijkheidskenmerken kan onthullen
- Een konijn ontleden
- Hoogtepunt:quasi-kristallijne bestelling op nanoschaal
- Ontwikkeling van massaproductieapparatuur voor dun magneetlint, minimaliseren van energieverlies
- Kleine kristallen maken de weg vrij voor een nieuw ontwerp van digitale apparaten

- 'S Werelds meest efficiënte nanoplasmonische zonnecellen ontwikkeld
- Kunststofproducten kunnen gemakkelijk elektronisch worden met de eerste vormbare circuits van volledig koolstof

 Met vindingrijkheid en solidariteit, Cubanen bereiden zich voor op Irma
Met vindingrijkheid en solidariteit, Cubanen bereiden zich voor op Irma Mechanisme achter platinakatalysator gevangen
Mechanisme achter platinakatalysator gevangen Vraag en antwoord:wat is bitcoin?
Vraag en antwoord:wat is bitcoin? Zelfs een kleine kernoorlog zou een ecologische ramp zijn die over de hele wereld wordt gevoeld
Zelfs een kleine kernoorlog zou een ecologische ramp zijn die over de hele wereld wordt gevoeld Gegoten uit het verleden:'s Werelds oudste zinkende vissersnetten gevonden in Zuid-Korea
Gegoten uit het verleden:'s Werelds oudste zinkende vissersnetten gevonden in Zuid-Korea Bouwsteen van thermische computer werkt op 600 K
Bouwsteen van thermische computer werkt op 600 K Vernietigen waterscooters de planeet?
Vernietigen waterscooters de planeet?  Afstembare derde harmonische generatie in grafeen maakt de weg vrij voor snelle optische communicatie en signaalverwerking
Afstembare derde harmonische generatie in grafeen maakt de weg vrij voor snelle optische communicatie en signaalverwerking
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

