
Wetenschap
Onderzoekers ontdekken een trigger voor gerichte celbeweging
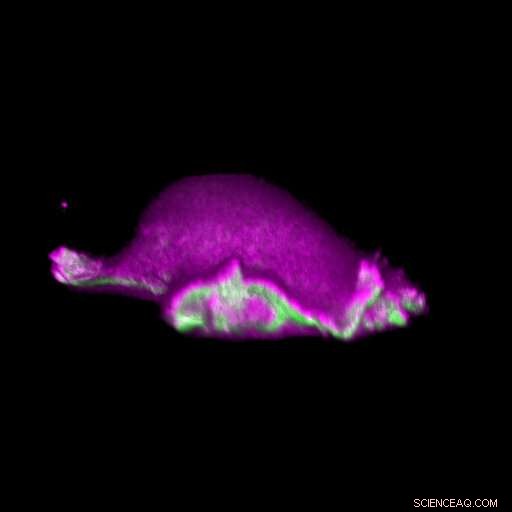
Een cel gaat vooruit:I-BAR-eiwitten (roze) hopen zich op op de plek waar het lamellipodium kromt. Daarbij, de cel kan lokaal het eiwit actine (groen) rangschikken en een lamellipodiale cyclus genereren. Krediet:Isabell Begemann, Milos Galic
Wanneer een individuele cel op een vlakke ondergrond wordt geplaatst, het staat niet stil, maar begint te bewegen. Dit fenomeen werd al in 1967 waargenomen door de Britse celbioloog Michael Abercrombie. onderzoekers zijn erin geslaagd te begrijpen hoe cellen deze prestatie volbrengen. Er is zoveel bekend:cellen vormen zogenaamde lamellipodia - cellulaire uitsteeksels die continu groeien en samentrekken - om zichzelf voort te stuwen naar signaalsignalen zoals chemische lokstoffen die door andere cellen worden geproduceerd en uitgescheiden. Wanneer dergelijke externe signalen ontbreken - zoals in de waarneming door Abercrombie - gaan cellen er actief naar op zoek. Daarbij, ze gebruiken zoekpatronen die ook bij haaien kunnen worden waargenomen, bijen of honden. Ze bewegen tijdelijk in één richting, stop, even ter plaatse wiebelen, en ga dan verder in een andere richting. Maar hoe behouden cellen de richting van hun beweging over een langere periode?
Onderzoekers van het Cells-in-Motion Cluster of Excellence van de Universiteit van Münster (Duitsland) rapporteren nu een antwoord op deze vraag. Ze ontdekten dat membraangeometrie volgende lamellipodiale cycli kan veroorzaken:mechanische krachten veroorzaken de vorming van membraankromming waar bepaalde eiwitten die deze geometrie herkennen samenkomen. Deze eiwitten, beurtelings, laat de cel de lamellipodia vormen. "De kromming, gegenereerd tijdens het terugtrekken bepaalt vooraf de groei van de volgende lamellipodiale cyclus. Zo activeert het mechanisme zichzelf voortdurend, " legt bioloog Dr. Milos Galic uit, junior onderzoeksgroepleider bij het Cluster of Excellence, en senior auteur van de studie. Wanneer externe signalen ontbreken, een cel stopt niet alleen om de tijd te markeren - hij gaat even in één richting en patrouilleert efficiënt in zijn omgeving. Het onderzoek is gepubliceerd in de Natuurfysica logboek.
Het startpunt van het onderzoek was een verrassende observatie die werd gedaan bij het analyseren van microscopische beelden. De onderzoekers onderzochten hoe cellen lamellipodia vormden en, als gevolg, hoe de beweging en vorm van cellen veranderden. Ze ontdekten dat de lamellipodia evolueerde over een breed scala aan maten en een zeer verschillende levensduur hadden.
"Bij de gegevens we konden geen terugkerend patroon herkennen in de groei en samentrekking van lamellipodia, " zegt hoofdauteur Dr. Isabell Begemann, een bioloog die het onderzoek uitvoerde in het kader van haar proefschrift. De onderzoekers konden vaststellen dat plaatsen van daaropvolgende lamellipodia-extensie plaatsvonden waar het celmembraan een sterke kromming ontwikkelde. Ze veronderstelden daarom dat een mechanisme dat aan deze krommingen is gekoppeld, continue bewegingscycli kan bepalen en, als gevolg, bewegingspersistentie.
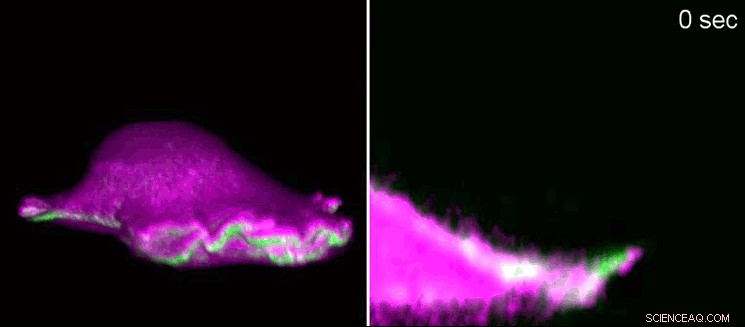
Een fibroblast van een muis beweegt naar voren met behulp van een "lamellipodium". Aan je linker kant, zijaanzicht in 3D, aan de rechterkant, een dwarsdoorsnede die inzoomt op het lamellipodium. I-BAR-eiwitten (roze) hopen zich op aan het begin van het lamellipodium als gevolg van de kromming van het celmembraan. Als gevolg hiervan, de cel kan plaatselijk het eiwit actine (groen) regelen en het lamellipodium groeit weer aan. Met behulp van roosterlicht-fluorescentiemicroscopie, de onderzoekers toonden de minuscule structuren in 3D. Lamellipodia hebben een hoogte van 100 tot 200 nanometer. Krediet:Isabell Begemann, Milos Galic
Biologen, biochemici en natuurkundigen werkten nauw samen om dit idee te onderzoeken. Ze ontwikkelden eerst biosensoren om sterk gekromde plaatsen op het celmembraan te labelen, en visualiseerden ze door verschillende middelen van microscopie met hoge resolutie. Hiertoe, ze verbonden fluorescerende moleculen met zogenaamde I-BAR-domeinen. Dit zijn banaanvormige eiwitgebieden waarvan de positief geladen kant het negatief geladen celmembraan bindt, maar alleen als het membraan gebogen is.
Door gebruik te maken van deze biosensoren, de onderzoekers konden aantonen dat de kromminggevoelige eiwitten zich ophopen op plaatsen waar het lamellipodium samentrekt. Eenmaal verrijkt, deze eiwitten induceren uitstekende krachten in de cel via het eiwit actine, die de uitgroei van het lamellipodium in gang zet. In een volgende stap, de onderzoekers ontwikkelden een wiskundig model dat het mechanisme reconstrueert en simuleerden het op de computer met behulp van verschillende parametercombinaties. Door de voorspellingen die zijn afgeleid van het wiskundige model te vergelijken met aanvullende experimentele beeldgegevens, werden de tot nu toe gevonden resultaten verder versterkt.
De onderzoekers vonden bewijs voor de aanwezigheid van het geïdentificeerde motiliteitsmechanisme in celcultuurmodellen, bijvoorbeeld, in bindweefselcellen afkomstig van muizen, in menselijke bloedvatcellen van de navelstreng, en ook in menselijke immuuncellen, d.w.z. een celtype dat inderdaad vrij in het organisme beweegt. Eindelijk, de onderzoekers wilden ook weten welke effecten het voorgestelde mechanisme had op het beweeglijkheidspatroon van een cel.
"We hebben de I-BAR-eiwitten naar beneden gereguleerd, waardoor we het zelforganisatiesysteem van de cel kunnen hacken, " zegt Milos Galic. Zonder het mechanisme, de cel kan nog steeds bewegen, maar het zoekgebied wordt aanzienlijk kleiner. Parallel aan dit mechanisme er zijn andere machines die met elkaar verweven zijn, maar het mechanisme heeft invloed op het beweeglijkheidspatroon van een cel. De resultaten van het onderzoek kunnen, in de toekomst, helpen bij het beantwoorden van fundamentele vragen over processen in organismen waarbij vrij bewegende cellen betrokken zijn.
 Nieuwe carbon dot-gebaseerde methode om de efficiëntie van zonnecellen en leds te verhogen
Nieuwe carbon dot-gebaseerde methode om de efficiëntie van zonnecellen en leds te verhogen Wetenschappers gebruiken moleculaire kettingen en chemische lichtsabels om platforms te bouwen voor tissue engineering
Wetenschappers gebruiken moleculaire kettingen en chemische lichtsabels om platforms te bouwen voor tissue engineering Hoe is neopreen gemaakt?
Hoe is neopreen gemaakt?  Nieuwe technologie verbetert de productie van waterstof
Nieuwe technologie verbetert de productie van waterstof Chemici testen een nieuwe nanokatalysator voor het verkrijgen van waterstof
Chemici testen een nieuwe nanokatalysator voor het verkrijgen van waterstof
 Koudst geregistreerde wolkentemperatuur gemeten door satelliet
Koudst geregistreerde wolkentemperatuur gemeten door satelliet Computermodel toont oude aarde met een atmosfeer van 70 procent koolstofdioxide
Computermodel toont oude aarde met een atmosfeer van 70 procent koolstofdioxide Oceanografen onthullen verband tussen migrerende Golfstroom en opwarmend oceaanwater
Oceanografen onthullen verband tussen migrerende Golfstroom en opwarmend oceaanwater Nieuwe studie suggereert dat de koolstofput op het land in de VS mogelijk is overschat
Nieuwe studie suggereert dat de koolstofput op het land in de VS mogelijk is overschat What Do River Otters Eat?
What Do River Otters Eat?
Hoofdlijnen
- Zoogdieren schakelden over op dagactiviteit na uitsterven van dinosauriërs
- Wat is een extra ring van DNA in bacteriën?
- Hoe Spaced Repetition examen tijd een fluitje van een cent kan maken
- Wat zijn de rollen van chlorofyl A & B?
- Wilde druivengist kan effectiever zijn dan pesticiden bij het voorkomen van druivenschimmels
- Wat zijn de twee belangrijkste functies van nucleïnezuur in levende wezens?
Nucleïnezuren zijn kleine stukjes materie met grote rollen om te spelen. Genoemd naar hun locatie - de kern - deze zuren dragen informatie die cellen helpt bij het maken va
- Amazoneboeren ontdekten het geheim van het domesticeren van wilde rijst 4, 000 jaar geleden
- Structurele inzichten in processen op DNA-schadeplekken
- Wanneer is de beste tijd van de dag om een beslissing te nemen?
- Elektron-elektron en spin-baan interacties concurreren om het elektron te controleren

- Onzichtbaarheidsmantel dichter bij realiteit

- Er is geen manier om de lichtsnelheid in één richting te meten

- Wanneer warmte ophoudt een mysterie te zijn, spintronica wordt reëler

- Wetenschappers fabriceren een nieuwe klasse kristallijne vaste stoffen
 Nanocomposieten met rijke zuurstofvacatures bevorderen gevoelige elektroanalyse van Hg(II)
Nanocomposieten met rijke zuurstofvacatures bevorderen gevoelige elektroanalyse van Hg(II) Invloeden van zonnewind op gigantische ruimte-orkanen kunnen de veiligheid van satellieten beïnvloeden
Invloeden van zonnewind op gigantische ruimte-orkanen kunnen de veiligheid van satellieten beïnvloeden Onderzoekers verbeteren de voorspellingen van de tropische cycloonintensiteit in het westen van de Noordelijke Stille Oceaan met behulp van de logistische groeivergelijking
Onderzoekers verbeteren de voorspellingen van de tropische cycloonintensiteit in het westen van de Noordelijke Stille Oceaan met behulp van de logistische groeivergelijking Waarom vrouwen – inclusief feministen – zich nog steeds aangetrokken voelen tot welwillend seksistische mannen
Waarom vrouwen – inclusief feministen – zich nog steeds aangetrokken voelen tot welwillend seksistische mannen Wetenschappers onthullen mechanisme van dizuurstofactivering
Wetenschappers onthullen mechanisme van dizuurstofactivering Nieuwe screeningsmethode ontwikkeld om te bevestigen of deuteratie de metabole stabiliteit verbetert
Nieuwe screeningsmethode ontwikkeld om te bevestigen of deuteratie de metabole stabiliteit verbetert Onderzoekers ontwikkelen unieke methode om uniforme nanodeeltjes te maken
Onderzoekers ontwikkelen unieke methode om uniforme nanodeeltjes te maken Deepfake-video's vormen een bedreiging, maar dumbfas zijn misschien erger
Deepfake-video's vormen een bedreiging, maar dumbfas zijn misschien erger
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

