
Wetenschap
Structurele inzichten in processen op DNA-schadeplekken
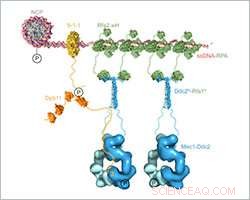
Op schaal samengesteld structureel model van de Mec1-Ddc2-RPA-assemblage en activering op DNA-schadeplaatsen. Krediet:Friedrich Miescher Instituut voor biomedisch onderzoek
Ishan Deshpande en zijn collega's van de groep van Susan Gasser en de Protein Structure Facility bij de FMI lichtten het mechanisme toe van hoe Mec1-Ddc2, een tumorsuppressor die betrokken is bij de reactie op DNA-schade, verzamelt zich op plaatsen van DNA-schade. Ze richten zich op de Ddc2-RPA-interactie, die het Mec1-Ddc2-kinasecomplex naar enkelstrengs DNA brengt op plaatsen van DNA-schade. Met hun structurele gegevens, de FMI-wetenschappers bieden de ontbrekende schakel tussen twee eerder gepubliceerde structuren, waardoor ze een op schaal samengesteld structureel model van Mec1-Ddc2 op ssDNA-RPA op DNA-schadeplaatsen konden samenstellen.
Het ATR-kinase trekt al meer dan 20 jaar belangstelling. Dit kinase is een van de twee kinasen die centraal DNA-schade detecteren in zoogdiercellen, en het is ook een tumorsuppressor. Twee verbindingen die ATR-kinase remmen, zijn in klinische onderzoeken voor de behandeling van leukemie en solide tumoren. Nog, hoe dit enzym op moleculair niveau wordt gereguleerd, is ongrijpbaar gebleven.
Ishan Deshpande, een PhD student in de Protein structure facility en de groep van Susan Gasser aan het Friedrich Miescher Institute for Biomedical Research (FMI), heeft nu het mechanisme opgehelderd hoe de gisthomoloog van ATR, Mec1, assembleert op plaatsen van DNA-schade voor plaatsspecifieke activering.
in gist, zoals bij mensen, Mec1 vormt een complex met een regulerende subeenheid genaamd Ddc2 (ATRIP bij mensen). Bij DNA-schade, grote stukken enkelstrengs DNA (ssDNA) worden blootgelegd, die snel worden gedekt door replicatie-eiwit A (RPA). Mec1-Ddc2 herkent deze ssDNA-RPA-rekken en hoopt zich op deze plaatsen op om reparatiemechanismen te initiëren.
Deshpande en collega's hebben nu de 3D-structuur van de Ddc2 N-terminus opgelost in samenwerking met een deel van RPA, waardoor structurele gegevens worden verstrekt over de link tussen RPA en Mec1, die tot nu toe ongrijpbaar was. We verkregen een co-kristalstructuur met hoge resolutie van de Ddc2 N-terminus samen met een subeenheid van RPA, Deshpande uitgelegd. Met deze gegevens, we konden aantonen dat Ddc2 homodimeren vormt en RPA bindt via zijn N-terminus. interessant, onze Ddc2-RPA-structuur is de ontbrekende schakel tussen twee eerder gepubliceerde structuren, en dit stelt ons in staat om een op schaal samengesteld structureel model van Mec1-Ddc2 op ssDNA-RPA op DNA-beschadigingsplaatsen samen te stellen.
De Ddc2 N-terminus faciliteert niet alleen Mec1-interactie met RPA, maar fungeert ook als een spacer voor het Mec1-kinase. Deshpande legt uit:De langwerpige Ddc2 N-terminus zorgt ervoor dat de grote Mec1-kinasemodule kan bewegen zonder het beschadigde DNA of de reparatiemachines die aan de laesie werken, tegen te komen. In aanvulling, de Ddc2-spacer kan Mec1 in staat stellen meerdere ruimtelijk verschillende substraten te fosforyleren terwijl het gebonden blijft aan de plaats van DNA-schade. Je kunt het Ddc2 N-uiteinde zien als de nek van een giraf waarmee de giraf zowel het gras op de grond als de bladeren van een hoge boom kan bereiken.
Een juiste Mec1-Ddc2-activiteit is belangrijk voor alle soorten DNA-schadeherstel. Echter, de functionele gegevens van Deshpande en collega's geven aan dat de Ddc2 N-terminus bijzonder belangrijk is voor celoverleving na DNA-schade door UV-licht. Ons model suggereert dat de loutere rekrutering van Mec1-Ddc2 naar ssDNA kan bijdragen aan de homodimerisatie en dus activering van het Mec1-Ddc2-complex, legt Deshpande uit.
In aanvulling, Susan Gasser wijst erop "dat dit een geweldige samenwerking is geweest tussen mijn lab en de structuurfaciliteit van de FMI, waardoor we een brug kunnen slaan van structuur naar functie."
Hoofdlijnen
- Onderzoek suggereert dat gevaarlijke gewassenschimmel giftige chemicaliën produceert om insecten af te weren
- Studie identificeert nieuwe malariaparasieten in wilde bonobo's
- Live 3D-beeldvorming benadrukt cellulaire activiteit tijdens embryonale hartontwikkeling
- Een model van een cel-kern maken
- Waarom worden we ziek?
- Op weg naar pesticidebewaking
- Flagella: soorten, functie en structuur
- Wat is het principe van parsimony in de biologie?
- Smartphone-app gebruikt computervisie om verloren dieren te identificeren
- Onderzoek naar roodrugspinnen vindt dat schijnbaar weerzinwekkende paringsstrategie zowel mannen als vrouwen ten goede komt

- De Krebs-cyclus gemakkelijk gemaakt

- Wat gebeurt er als er sprake is van mitose?
- Microbieel ecosysteem bij Laguna La Brava kan nieuwe micro-organismen bevatten

- Een keep-fit gadget voor uw hond deze kerst - wie heeft er echt baat bij?

 Dwaalt Marie Antoinette nog steeds door de zalen van Versailles?
Dwaalt Marie Antoinette nog steeds door de zalen van Versailles?  Hoe Amerikaanse gasprijzen om te rekenen naar liter
Hoe Amerikaanse gasprijzen om te rekenen naar liter  Nieuwe inzichten in de kwetsbaarheid van overstromingen in de VS onthuld door big data over overstromingsverzekeringen
Nieuwe inzichten in de kwetsbaarheid van overstromingen in de VS onthuld door big data over overstromingsverzekeringen Pathologische macht:het gevaar van regeringen onder leiding van narcisten en psychopaten
Pathologische macht:het gevaar van regeringen onder leiding van narcisten en psychopaten Algoritme kan winnaar van debat voorspellen
Algoritme kan winnaar van debat voorspellen Nieuw economisch dashboard kan dienen als vroegtijdig waarschuwingssysteem voor recessies op staatsniveau, andere economische schokken
Nieuw economisch dashboard kan dienen als vroegtijdig waarschuwingssysteem voor recessies op staatsniveau, andere economische schokken Natuurkundigen produceren 's werelds eerste neutronenrijke, radioactieve tantaalionen
Natuurkundigen produceren 's werelds eerste neutronenrijke, radioactieve tantaalionen Obama zet stappen om Trumps handen vast te binden aan Arctic, Atlantische boringen
Obama zet stappen om Trumps handen vast te binden aan Arctic, Atlantische boringen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


