
Wetenschap
Wetenschappers gebruiken moleculaire kettingen en chemische lichtsabels om platforms te bouwen voor tissue engineering
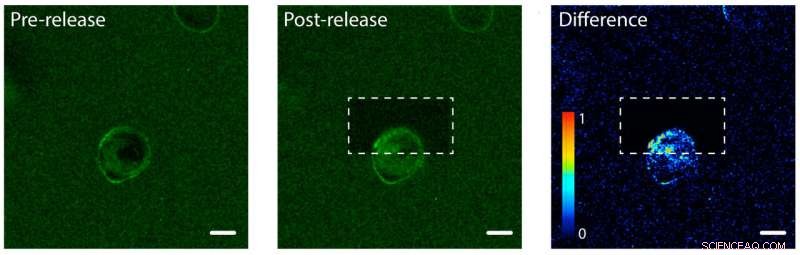
Fotoafgifte van epidermale groeifactor (EGF) eiwitten aan één kant van een menselijke cel. Links:EGF (groen) is vastgemaakt aan een hydrogel, een enkele menselijke cel (midden). Het celmembraan bindt EGF, waardoor het membraan groen wordt. Midden:De hydrogel na gebruik van een laser om EGF-eiwitten los te maken en vrij te geven op het bovenste gedeelte van de cel. Rechts:een afbeelding die het verschil in groene fluorescerende kleur laat zien tussen post- en pre-release-afbeeldingen. Let op de toename in kleur in het bovenste gedeelte van de cel, wat aangeeft dat de cel is begonnen de ongebonden EGF-eiwitten te internaliseren, maar slechts aan één kant. Schaalbalk is 10 micrometer. Krediet:Shadish, Benuska en DeForest, 2019, Natuurmaterialen
Tissue engineering zou de geneeskunde kunnen transformeren. In plaats van te wachten tot ons lichaam weer aangroeit of schade herstelt na een verwonding of ziekte, wetenschappers kunnen complex worden, volledig functionele weefsels in een laboratorium voor transplantatie in patiënten.
Eiwitten zijn de sleutel tot deze toekomst. In ons lichaam, eiwitsignalen vertellen cellen waar ze heen moeten, wanneer verdelen en wat te doen. In het labortorium, wetenschappers gebruiken eiwitten voor hetzelfde doel:het plaatsen van eiwitten op specifieke punten op of in geconstrueerde steigers, en vervolgens deze eiwitsignalen te gebruiken om celmigratie te controleren, deling en differentiatie.
Maar eiwitten in deze omgevingen zijn ook kwetsbaar. Om ze aan de steigers te laten kleven, onderzoekers hebben traditioneel eiwitten gemodificeerd met behulp van chemicaliën die meer dan 90 procent van hun functie doden. In een paper gepubliceerd op 20 mei in het tijdschrift Natuurmaterialen , een team van onderzoekers van de Universiteit van Washington onthulde een nieuwe strategie om eiwitten intact en functioneel te houden door ze op een specifiek punt aan te passen, zodat ze met licht chemisch aan de steiger kunnen worden vastgemaakt. Omdat de ketting ook met laserlicht kan worden doorgesneden, deze methode kan evoluerende patronen van signaaleiwitten creëren in een biomateriaal-steiger om weefsels te laten groeien die uit verschillende soorten cellen bestaan.
"Eiwitten zijn de ultieme communicatoren van biologische informatie, " zei corresponderende auteur Cole DeForest, een UW-assistent-professor chemische technologie en bio-engineering, evenals een aangesloten onderzoeker bij het UW Institute for Stem Cell &Regenerative Medicine. "Ze sturen vrijwel alle veranderingen in celfunctie aan - differentiatie, beweging, groei, dood."
Om die reden, wetenschappers hebben lang eiwitten gebruikt om celgroei en differentiatie in tissue engineering te beheersen.
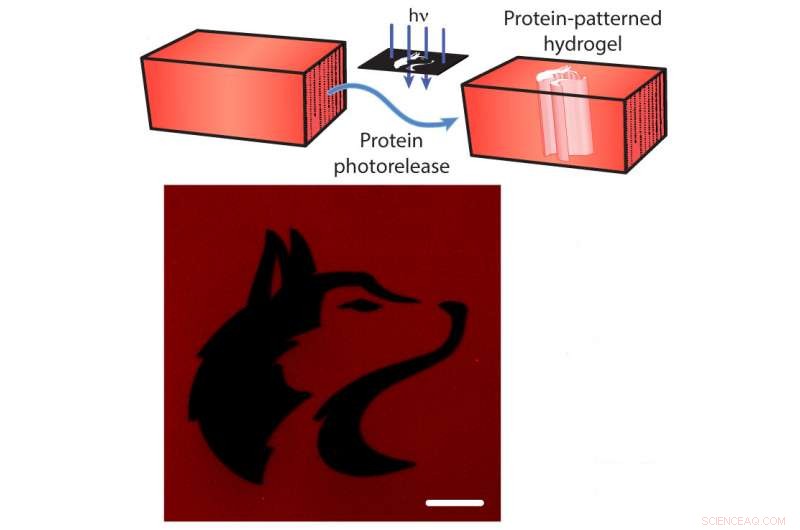
Photorelease van eiwitten uit een hydrogel. Boven:De mCherry rode fluorescerende eiwitten zijn vastgemaakt aan de hydrogel. Onderzoekers kunnen de ketting doorknippen met gericht licht (blauwe pijlen), het vrijgeven van de mCherry van de hydrogel (blauwe pijlen). Onderkant:een afbeelding van de hydrogel na de release van mCherry in de vorm van de mascotte van de Universiteit van Washington (zwart). Schaalbalk is 100 micrometer. Krediet:Shadish, Benuska en DeForest, 2019, Natuur materialen.
"Maar de chemicaliën die door de gemeenschap het meest worden gebruikt om eiwitten aan materialen te binden, inclusief steigers voor tissue engineering, vernietigen de overgrote meerderheid van hun functie, " zei DeForest, die ook een faculteitslid is van het UW Molecular &Engineering Sciences Institute. "Historisch, onderzoekers hebben geprobeerd dit te compenseren door de scaffold simpelweg te overladen met eiwitten, wetende dat de meesten van hen inactief zullen zijn. Hier, we hebben een generaliseerbare manier bedacht om biomaterialen omkeerbaar te functionaliseren met eiwitten, terwijl ze hun volledige activiteit behouden."
Hun aanpak maakt gebruik van een enzym genaamd sortase, die in veel bacteriën voorkomt, om een kort synthetisch peptide toe te voegen aan elk signaaleiwit op een specifieke locatie:de C-terminus, een plaats aanwezig op elk eiwit. Het team ontwerpt dat peptide zodanig dat het het signaaleiwit aan specifieke locaties vastbindt in een met vloeistof gevulde biomateriaal-steiger die gebruikelijk is in weefseltechnologie, bekend als een hydrogel.
Het richten op een enkele site op het signaaleiwit is wat de aanpak van het UW-team onderscheidt. Andere methoden wijzigen signaaleiwitten door chemische groepen aan willekeurige locaties te hechten, die vaak de functie van het eiwit verstoort. Het wijzigen van alleen de C-terminus van het eiwit verstoort veel minder de functie ervan, volgens DeForest. Het team testte de aanpak op meer dan een half dozijn verschillende soorten eiwitten. De resultaten tonen aan dat het wijzigen van de C-terminus geen significant effect heeft op de eiwitfunctie, en bindt met succes de eiwitten door de hydrogel.
Hun aanpak is analoog aan het ophangen van een ingelijste kunst aan een muur. In plaats van willekeurig spijkers door het glas te slaan, doek en lijst, ze rijgen een enkele draad over de achterkant van elk frame om het aan de muur te hangen.
In aanvulling, de koorden kunnen worden doorgesneden door blootstelling aan gericht laserlicht, het veroorzaken van "photorelease" van de eiwitten. Met behulp van dit wetenschappelijke lichtzwaard kunnen de onderzoekers een hydrogel laden met veel verschillende soorten eiwitsignalen, en stel de hydrogel vervolgens bloot aan laserlicht om eiwitten uit bepaalde secties van de hydrogel los te maken. Door selectief slechts delen van de materialen aan het laserlicht bloot te stellen, het team controleerde waar eiwitsignalen aan de hydrogel zouden blijven vastzitten.

Van links naar rechts:Cole DeForest, Gabrielle Benuska, Jared Shadish. Credit:Dennis Wise/Universiteit van Washington
Het losmaken van eiwitten is nuttig in hydrogels omdat cellen die signalen dan kunnen opnemen, ze in het binnenste van de cel brengen waar ze processen zoals genexpressie kunnen beïnvloeden.
Het team van DeForest testte het photorelease-proces met een hydrogel geladen met epidermale groeifactor, een soort eiwitsignaal. Ze brachten een menselijke cellijn in de hydrogel en observeerden de groeifactoren die aan de celmembranen binden. Het team gebruikte een laserstraal om de eiwitsignalen aan één kant van een individuele cel los te maken, maar niet de andere kant. Aan de vastgebonden kant van de cel, de eiwitten bleven aan de buitenkant van de cel omdat ze nog aan de hydrogel vastzaten. Aan de ongebonden kant, de eiwitsignalen werden door de cel geïnternaliseerd.
"Op basis van hoe we het laserlicht richten, we kunnen ervoor zorgen dat verschillende cellen - of zelfs verschillende delen van afzonderlijke cellen - verschillende omgevingssignalen ontvangen, ', aldus DeForest.
Dit unieke niveau van precisie binnen een enkele cel helpt niet alleen bij tissue engineering, maar met fundamenteel onderzoek in celbiologie, voegde DeForest toe. Onderzoekers zouden dit platform kunnen gebruiken om te bestuderen hoe levende cellen reageren op meerdere combinaties van eiwitsignalen, bijvoorbeeld. Deze onderzoekslijn zou wetenschappers helpen begrijpen hoe eiwitsignalen samenwerken om celdifferentiatie te controleren, ziek weefsel genezen en de menselijke ontwikkeling bevorderen.
"Dit platform stelt ons in staat om precies te controleren wanneer en waar bioactieve eiwitsignalen worden gepresenteerd aan cellen in materialen, "zei DeForest. "Dat opent de deur naar vele opwindende toepassingen in weefselengineering en therapeutisch onderzoek."
 Studie identificeert meest veelbelovende grondstoffen voor op pyrolyse gebaseerde bioraffinage
Studie identificeert meest veelbelovende grondstoffen voor op pyrolyse gebaseerde bioraffinage Hoe gemeenschappelijke elementen een meer energiezekere toekomst kunnen maken
Hoe gemeenschappelijke elementen een meer energiezekere toekomst kunnen maken Zelftests bouwen voor 's werelds meest voorkomende infectieziekten - met papier
Zelftests bouwen voor 's werelds meest voorkomende infectieziekten - met papier Verschillen tussen Transition Metals & Inner Transition Metals
Verschillen tussen Transition Metals & Inner Transition Metals  Waarom sommige groenen bruin worden in historische schilderijen
Waarom sommige groenen bruin worden in historische schilderijen
 Mega-infrastructuurprojecten in Afrika, Azië en Latijns-Amerika geven vorm aan ontwikkeling
Mega-infrastructuurprojecten in Afrika, Azië en Latijns-Amerika geven vorm aan ontwikkeling Wat heeft de zon te maken met de koolstofcyclus?
Wat heeft de zon te maken met de koolstofcyclus?  Klimaatverandering kan binnenkort miljarden mensen treffen - veel steden ondernemen al actie
Klimaatverandering kan binnenkort miljarden mensen treffen - veel steden ondernemen al actie UITLEG:Grote gevaren in het verschiet voor Spaans vulkanisch eiland
UITLEG:Grote gevaren in het verschiet voor Spaans vulkanisch eiland Kunnen we van zuiveringsslib iets waardevols maken?
Kunnen we van zuiveringsslib iets waardevols maken?
Hoofdlijnen
- Zwaarlijvige honden geholpen door effectieve gewichtsverliesproeven
- Waarom is het zo moeilijk voor soorten om hun ecologische niche te verlaten?
- Een functionele genomics-database voor onderzoeken naar het microbioom van planten
- Nieuw raamwerk om microbiële interacties af te leiden
- Het belang van het bestuderen van de DNA-genetica van het menselijk geslacht
- Definitie van menselijke biologie
- Celfysiologie: een overzicht van structuur, functie en gedrag
- Wat is de functie van tracking-kleurstof in gelelektroforese?
- Make-up en wetenschap Eerlijke ideeën
- Saptechniek kan de gezondheid van vers geperst sap beïnvloeden

- Nieuwe macrolacton-database kan helpen bij het ontdekken van medicijnen, Onderzoek

- Houtalternatieven vinden voor bedreigde ebbenhout

- Een type semi-transparant polymeer dat bij kamertemperatuur kan worden hersteld met een kleine druk

- Overtollige suiker helpt wittevlieg om de afweer van planten te ontgiften

 De rol van intuïtie in muziekuitvoeringen
De rol van intuïtie in muziekuitvoeringen Verschil tussen 6011 en 7018 lasstaven
Verschil tussen 6011 en 7018 lasstaven Eilandbouw in Zuidoost-Azië zorgde voor noordelijke ijskappen op aarde
Eilandbouw in Zuidoost-Azië zorgde voor noordelijke ijskappen op aarde Diddy zorgt voor wat COVID-19-hulp voor de buurt van Miami
Diddy zorgt voor wat COVID-19-hulp voor de buurt van Miami Fossil Hunting in Tennessee
Fossil Hunting in Tennessee Ultra-zeldzaam kaon-verval zou kunnen leiden tot bewijs van nieuwe fysica
Ultra-zeldzaam kaon-verval zou kunnen leiden tot bewijs van nieuwe fysica Dagelijkse regenval boven Sumatra gekoppeld aan groter atmosferisch fenomeen
Dagelijkse regenval boven Sumatra gekoppeld aan groter atmosferisch fenomeen Hoge temperaturen in maart verkortten het winterweer in Alaska
Hoge temperaturen in maart verkortten het winterweer in Alaska
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

