
Wetenschap
Parkinson-gerelateerd eiwit is afstembaar
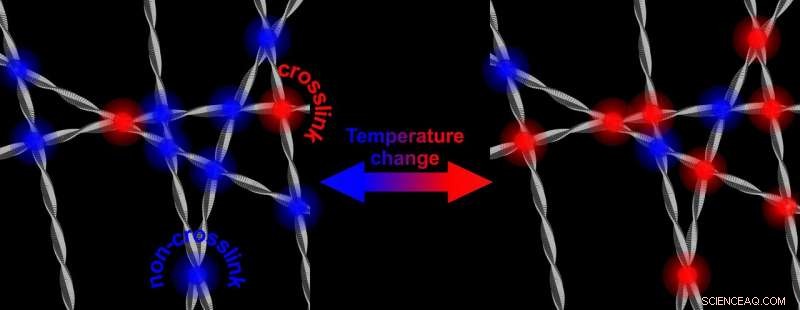
Bij hogere temperaturen, er zijn meer verknopingen die het netwerk van eiwitfibrillen verstevigen. Het verlagen van de temperatuur resulteert in een netwerk dat weer minder stijf is. Credit:Universiteit Twente
Fibrillen van het eiwit alfa-synucleïne, dat een rol speelt bij de ziekte van Parkinson, een stijver en sterker netwerk in water vormen, wanneer de temperatuur wordt verhoogd. Onderzoekers van de Universiteit Twente laten zien dat dit te maken heeft met het waterafstotende deel van de vezels dat naar de oppervlakte komt en op elkaar inwerkt. Het mechanisme zou ook een rol kunnen spelen in de interactie met gezonde cellen. Onderzoekers van de Universiteit Twente publiceren erover in Fysieke beoordelingsbrieven van 17 mei.
Alfa-synucleïne is overvloedig aanwezig in onze hersenen. Het is bekend dat het zich tegen ons kan keren:bij neurodegeneratieve ziekten zoals Parkinson, het eiwit vertoont afwijkend gedrag:na het vormen van fibrillen, het eiwit kan plaques vormen. Het is nog niet bekend hoe dit mechanisme werkt. Het onderzoek dat de UT-wetenschappers nu presenteren, laat zien dat de eigenschappen van alfa-synucleïne 'afstembaar' zijn. in water, ze zullen een stijver en sterker netwerk vormen wanneer de temperatuur wordt verhoogd. Temperatuur weer verlagen, het netwerk wordt weer minder stijf. Hoewel dit alles plaatsvindt in een temperatuurbereik dat nooit in de hersenen zal plaatsvinden, het onderliggende mechanisme zou meer inzicht kunnen geven in de rol die de eiwitten spelen bij het ontstaan van ziekte. De afstembare stijfheid wordt veroorzaakt door 'hydrofobe interactie':het waterafstotende deel van de vezels is de aanwijzing.
Het onderzoek dat nu wordt gepresenteerd in Fysieke beoordelingsbrieven , laat zien dat de versterking van het netwerk wordt veroorzaakt door een toename van het aantal contactpunten van de fibrillen. Deze contactpunten bevinden zich allemaal in de hydrofobe delen van alfa-synucleïne. De reden waarom dit opmerkelijk is, is dat het hydrofobe deel normaal wordt 'afgeschermd' door de andere twee bouwstenen van het eiwit:een deel met een elektrische lading en een deel dat amfifiel is (het houdt van zowel water als lipiden). Dit schild wegnemen en het hydrofobe deel openen, kan ook een rol spelen bij de ziekte:dit deel kan gezonde cellen beschadigen.
Zelfs de natuurlijke afweermechanismen van de mens kunnen tegen ons werken, in dit geval. Eerder onderzoek toonde aan dat het 'opruimen' van de vijandige eiwitten meestal gebeurt door het deel dat elektrisch geladen is te 'knippen', waardoor het schild van het hydrofobe deel wordt weggenomen. De fibrillen kunnen nu contactpunten vinden, vormen netwerken en vallen celmembranen aan. Op deze manier, de natuurlijke bescherming wordt weggenomen.
Het onderzoek helpt de mechanismen te begrijpen, maar het kan ook inspireren b.v. nanotechnologen voor het creëren van nieuwe soorten kunstmatige structuren die kunnen worden afgestemd. Op het eerste gezicht, verstijving van het netwerk is bekend van polymeren, maar hydrofobe interactie is een heel ander mechanisme dat ook in kunstmatige structuren zou kunnen worden gebruikt.
 Chemicus stelt nieuwe methode voor voor het synthetiseren van voorlopers voor Parkinson-medicijnen
Chemicus stelt nieuwe methode voor voor het synthetiseren van voorlopers voor Parkinson-medicijnen Het opruimen van Tsjernobyl kan worden geholpen door een nieuwe benadering voor röntgenanalyse
Het opruimen van Tsjernobyl kan worden geholpen door een nieuwe benadering voor röntgenanalyse Nieuwe composietkatalysator belooft een kosteneffectieve conversie van ethanol naar vliegtuigbrandstof
Nieuwe composietkatalysator belooft een kosteneffectieve conversie van ethanol naar vliegtuigbrandstof Waarom smelt suiker?
Waarom smelt suiker?  Kooldioxide transformeren
Kooldioxide transformeren
 Nieuwe Amazon-dreiging? Ontbossing door mijnbouw
Nieuwe Amazon-dreiging? Ontbossing door mijnbouw Visserij in Tasmanië gekookt door recordbrekende hittegolf op zee
Visserij in Tasmanië gekookt door recordbrekende hittegolf op zee Georgia Tech gebruikt afvalwater van de campus om groenten te verbouwen
Georgia Tech gebruikt afvalwater van de campus om groenten te verbouwen  Het is tijd om accountants te trainen in duurzaamheid
Het is tijd om accountants te trainen in duurzaamheid Het vrijkomen van radioactieve deeltjes in Fukushima was significant, zegt nieuw onderzoek
Het vrijkomen van radioactieve deeltjes in Fukushima was significant, zegt nieuw onderzoek
Hoofdlijnen
- Microbieel ecosysteem bij Laguna La Brava kan nieuwe micro-organismen bevatten
- 10 misvattingen over GGO's
- Kenmerken van Animal-like Protists
- Meer stress en lagere overlevingskansen voor vogels bij jonge, beheerde bossen
- Producten geproduceerd door Anaerobe ademhaling
- Rechtshandige gewoonte is misschien 2 miljoen jaar geleden begonnen
- Het combineren van cassavemeel in het brooddeeg kan in de toekomst de toegang tot voedsel verzekeren
- Hebben garnalen een zenuwstelsel?
- Het verschil tussen histon en nonhistone
- Ontdekking van supergeleiding van bismut bij extreem lage temperatuur brengt theorie in gevaar

- Een nieuwe light-sheet microscopie-eenheid zorgt voor een groter gezichtsveld en minder fotoschade
- Recordbrekende efficiëntie voor veilige opslag van kwantumgeheugen

- De beste plaatsen om windturbines elektriciteit te laten produceren

- Exoplaneten gebruiken als donkeremateriedetectoren

 Wetenschappers bieden een kijkje in het leven tijdens een uitbarsting van de Caribische vulkaan
Wetenschappers bieden een kijkje in het leven tijdens een uitbarsting van de Caribische vulkaan De honger in de wereld is drie opeenvolgende jaren gestegen, en klimaatverandering is een oorzaak
De honger in de wereld is drie opeenvolgende jaren gestegen, en klimaatverandering is een oorzaak Op zoek naar de beste 3D-printmaterialen
Op zoek naar de beste 3D-printmaterialen Onderzoekers sporen nieuwe biokatalysatoren op
Onderzoekers sporen nieuwe biokatalysatoren op Onderzoekers bereiken ultieme resolutielimiet in fluorescentiemicroscopie
Onderzoekers bereiken ultieme resolutielimiet in fluorescentiemicroscopie Wetenschappers ontwikkelen op wolfraam gebaseerde waterstofdetectoren
Wetenschappers ontwikkelen op wolfraam gebaseerde waterstofdetectoren Onderzoek biedt uniek inzicht in uitstervingsdynamiek in het late Trias
Onderzoek biedt uniek inzicht in uitstervingsdynamiek in het late Trias NEEMO:ruimteuitrusting testen onder zee
NEEMO:ruimteuitrusting testen onder zee
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

