
Wetenschap
Onderzoekers bereiken ultieme resolutielimiet in fluorescentiemicroscopie
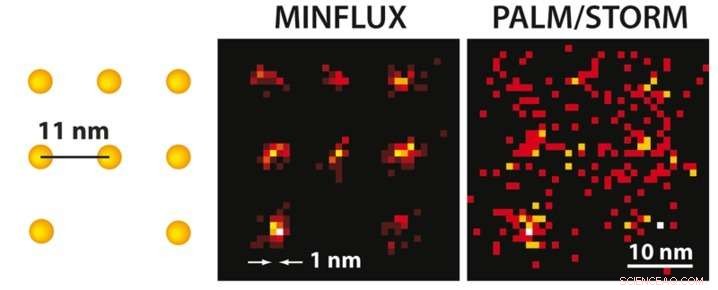
Met MINFLUX microscopie kan men, Voor de eerste keer, afzonderlijke moleculen optisch die slechts enkele nanometers van elkaar verwijderd zijn. Aan je linker kant, een schema van de fluorescerende moleculen wordt gepresenteerd. Terwijl de PALM/STORM-microscopie met ultrahoge resolutie bij dezelfde moleculaire helderheid (rechts) een diffuus beeld van de moleculen oplevert (hier in een simulatie onder ideale technische omstandigheden), de positie van de afzonderlijke moleculen kan gemakkelijk worden onderscheiden met de praktisch gerealiseerde MINFLUX (midden). Krediet:MPI f. Biofysische chemie/ K. Gwosch
Het is de heilige graal van de lichtmicroscopie:het oplossend vermogen van deze methode verbeteren zodat men moleculen die heel dicht bij elkaar liggen individueel kan onderscheiden. Wetenschappers rond Nobelprijswinnaar Stefan Hell van het Max Planck Instituut voor Biofysische Chemie in Göttingen hebben nu bereikt wat lange tijd voor onmogelijk werd gehouden:ze hebben een nieuwe fluorescentiemicroscoop ontwikkeld, genaamd MINFLUX, toestaan, Voor de eerste keer, om moleculen optisch te scheiden, die slechts nanometers (een miljoenste van een millimeter) van elkaar verwijderd zijn. Deze microscoop is meer dan 100 keer scherper dan conventionele lichtmicroscopie en overtreft zelfs de beste superresolutie lichtmicroscopiemethoden tot nu toe, namelijk STED ontwikkeld door Hell en PALM/STORM beschreven door Nobelprijswinnaar Eric Betzig, tot 20 keer. Voor MINFLUX, Hell gebruikte de voordelen van STED en PALM/STORM in een geheel nieuw concept. Deze doorbraak opent nieuwe mogelijkheden voor onderzoekers om te onderzoeken hoe het leven op moleculair niveau functioneert.
"We hebben routinematig resoluties van een nanometer bereikt met MINFLUX, dat is de diameter van individuele moleculen - de ultieme limiet van wat mogelijk is in fluorescentiemicroscopie, " legt Hell uit, Directeur van het Max Planck Instituut voor Biofysische Chemie. "Ik ben ervan overtuigd dat MINFLUX-microscopen de potentie hebben om een van de meest fundamentele instrumenten van de celbiologie te worden. Met dit concept wordt het mogelijk om cellen in moleculair detail in kaart te brengen en de snelle processen in hun interieur in realtime te observeren. Dit zou kunnen een revolutie teweegbrengen in onze kennis van de moleculaire processen die plaatsvinden in levende cellen."
De natuurkundige van Göttingen, die ook werkt bij het Max Planck Instituut voor Medisch Onderzoek en het Duitse Kankeronderzoekscentrum in Heidelberg, is er al lang van overtuigd dat de resolutie van fluorescentiemicroscopie kan worden verhoogd tot de dimensie van individuele moleculen - met klassiek gebruik van gefocust licht en conventionele lenzen.
In feite, de natuurkundige Ernst Abbe had in 1873 geformuleerd dat de resolutie van lichtmicroscopen beperkt is tot de helft van de golflengte van licht, dat is ongeveer 200 nanometer. Meer dan 100 jaar later, deze Abbe-limiet is nog steeds geldig. Echter, Hell was de eerste die aantoonde dat deze limiet kan worden overwonnen met STED-microscopie, die hij in 1994 bedacht en vijf jaar later experimenteel opstelde.
zowel STED als PALM/STORM, enkele jaren later ontwikkeld, behalen in de praktijk een scheidingsscherpte van zo'n 20 tot 30 nanometer, zo'n tien keer beter dan de Abbe-limiet. Voor de ontwikkeling van deze ultrahoge resolutie lichtmicroscopietechnieken, Hell en Betzig kregen samen met William E. Moerner de Nobelprijs voor de Scheikunde 2014.
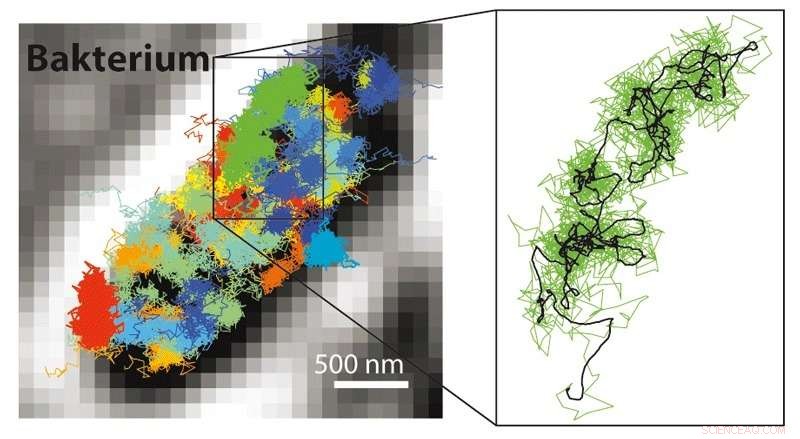
Met MINFLUX is het mogelijk om veel veel snellere bewegingen te volgen dan mogelijk is met STED of PALM/STORM microscopie. Het is daarom mogelijk om de bewegingen van met fluorescentie gelabelde moleculen zichtbaar te maken in een levende cel. Links:Bewegingspatroon van 30S ribosomen (onderdelen van eiwitfabrieken, gekleurd) in een E. coli-bacterie (zwart-wit). Rechts:bewegingspatroon van een enkel 30S-ribosoom (groen) vergroot weergegeven. Krediet:MPI f. Biofysische chemie / Y. Eilers
Voordelen van STED en PALM/STORM gecombineerd
Zowel STED als PALM/STORM scheiden naburige fluorescerende moleculen door ze een voor een aan en uit te schakelen, zodat ze sequentieel fluorescentie uitzenden. Echter, de methoden verschillen op één essentieel punt:STED-microscopie gebruikt een donutvormige laserstraal om moleculaire fluorescentie op een vaste locatie in het monster uit te schakelen, d.w.z. overal in het focusgebied behalve in het midden van de donut. Het voordeel is dat de donutstraal precies definieert op welk punt in de ruimte het corresponderende gloeiende molecuul zich bevindt. Het nadeel is dat in de praktijk de laserstraal niet sterk genoeg is om de emissie te beperken tot een enkel molecuul in het midden van de donut. In het geval van PALM/STORM, anderzijds, het in- en uitschakelen gebeurt op willekeurige plaatsen en op het niveau van één molecuul. Het voordeel hiervan is dat men al op het niveau van één molecuul werkt, maar een nadeel is dat men de exacte molecuulposities in de ruimte niet kent. De posities moeten worden gevonden door zoveel mogelijk fluorescentiefotonen op een camera te verzamelen; meer dan 50, Er zijn 000 gedetecteerde fotonen nodig om een resolutie van minder dan 10 nanometer te bereiken. In praktijk, men kan daarom niet routinematig een moleculaire (één nanometer) resolutie bereiken.
Hell had het idee om de sterke punten van beide methoden op unieke wijze te combineren in een nieuw concept. "Deze taak was allesbehalve triviaal. Maar mijn collega's Francisco Balzarotti, Yvan Eilers, en Klaus Gwosch hebben geweldig werk verricht door dit idee experimenteel met mij uit te voeren." Hun nieuwe techniek, genaamd MINFLUX (MINimale emissie FLUXes), wordt nu door Hell samen met de drie junior wetenschappers geïntroduceerd als eerste auteurs in Science.
MINFLUX, zoals PALM/STORM, schakelt individuele moleculen willekeurig in en uit. Echter, tegelijkertijd, hun exacte posities worden bepaald met een donutvormige laserstraal zoals in STED. In tegenstelling tot STED, de donutstraal wekt hier de fluorescentie op. Als het molecuul op de ring zit, het zal gloeien; als het precies in het donkere centrum is, het zal niet gloeien, maar men heeft zijn exacte positie gevonden. Balzarotti ontwikkelde een slim algoritme zodat deze positie zeer snel en met hoge precisie kon worden gelokaliseerd. "Met dit algoritme was het mogelijk om het potentieel van de donut-excitatiestraal te benutten, " legt de jonge wetenschapper uit. Gwosch, die de moleculair opgeloste beelden heeft verkregen, voegt toe:"Het was een ongelooflijk gevoel toen we, Voor de eerste keer, met MINFLUX details konden onderscheiden op de schaal van enkele nanometers."
100 keer betere resolutie
Naast de moleculaire resolutie, de combinatie van STED en PALM/STORM biedt een bijkomend groot voordeel:"MINFLUX is veel sneller in vergelijking. Omdat het werkt met een donut laserstraal, het vereist een veel lager lichtsignaal, d.w.z. minder fluorescentiefotonen, per molecuul in vergelijking met PALM/STORM voor het bereiken van de ultieme resolutie, Hell staten. Reeds met STED kon men real-time video's opnemen van de binnenkant van levende cellen. Maar nu was het mogelijk om de beweging van moleculen in een cel te volgen met een 100 keer betere temporele resolutie, zoals Eilers benadrukt. Hij slaagde erin om met MINFLUX voor het eerst de beweging van moleculen in een levende E. coli-bacterie te filmen, met een ongekende spatio-temporele resolutie. "Wat de snelheid betreft, we hebben de mogelijkheden met MINFLUX niet optimaal benut, ", zegt Eilers. De onderzoekers zijn ervan overtuigd dat zelfs extreem snel optredende veranderingen in levende cellen in de toekomst kunnen worden onderzocht, zoals bijvoorbeeld de beweging van cellulaire nanomachines of het vouwen van eiwitten.
 Experimentele observatie van de schaal van het elastische bereik in turbulente stroming met polymeeradditieven
Experimentele observatie van de schaal van het elastische bereik in turbulente stroming met polymeeradditieven DNA-enzym schudt celmembranen duizend keer sneller dan zijn natuurlijke tegenhanger
DNA-enzym schudt celmembranen duizend keer sneller dan zijn natuurlijke tegenhanger Hoe ethyleengas te maken
Hoe ethyleengas te maken  Microscoop op een chip kan medische expertise naar verre patiënten brengen
Microscoop op een chip kan medische expertise naar verre patiënten brengen Peptide-hydrogels kunnen traumatisch hersenletsel helpen genezen
Peptide-hydrogels kunnen traumatisch hersenletsel helpen genezen
Hoofdlijnen
- Instructies voor het maken van een JELL-O Cell
- Structurele inzichten in processen op DNA-schadeplekken
- Processen die ATP
- Bacteriën: definitie, soorten en voorbeelden
- Hoeveel weegt het leven?
- Geneesmiddelresistentie uit schimmels verdrijven
- Wat is het verschil tussen prokaryotische en eukaryote cellen?
- Landbouwproductiviteit dreef de Euro-Amerikaanse nederzetting van Utah
- Met extra suiker, bladeren worden ook dik
- Nieuw onderzoek kan worden gebruikt om kanker te behandelen, geneest gevechtswonden
- Panel kondigt Nobelprijs voor natuurkunde 2020 aan

- Kwantumwetenschappers aan het stuur zetten

- Astrofysische schokverschijnselen gereproduceerd in het laboratorium

- Observeren van hydrodynamische verschijnselen met licht via analogie tussen kwantumgassen en niet-lineaire optica
 iPhone 11:wat te verwachten en waarom wachten misschien de beste optie is
iPhone 11:wat te verwachten en waarom wachten misschien de beste optie is Weefselfase-sorptie-extractie voor goedkopere, sneller, en meer gevoelige biologische en milieubemonstering
Weefselfase-sorptie-extractie voor goedkopere, sneller, en meer gevoelige biologische en milieubemonstering Natuurkundigen vinden een manier om geladen moleculen te controleren - met kwantumlogica
Natuurkundigen vinden een manier om geladen moleculen te controleren - met kwantumlogica Hoe deeltjesconcentratie te berekenen
Hoe deeltjesconcentratie te berekenen 's Werelds eerste cultureel gevoelige robots voor ouderenzorg
's Werelds eerste cultureel gevoelige robots voor ouderenzorg Overdaad aan COVID-19-informatie leidt tot eenvoudige maar nutteloze keuzes
Overdaad aan COVID-19-informatie leidt tot eenvoudige maar nutteloze keuzes Hoe Drones een rol spelen in natuurbehoud
Hoe Drones een rol spelen in natuurbehoud Grote verliezen aan ammoniumstikstof uit een rijstecosysteem onder verhoogde kooldioxide
Grote verliezen aan ammoniumstikstof uit een rijstecosysteem onder verhoogde kooldioxide
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

