
Wetenschap
Hoe werken lithium-ionbatterijen?
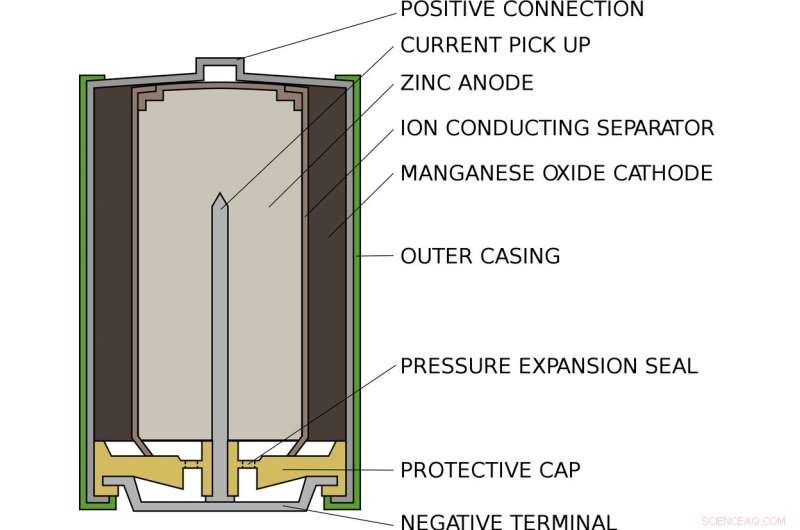
Hoe een standaard AA-alkalinebatterij er van binnen uitziet. Credit:hoofdhouder/Wikimedia Commons
Het smartphonetijdperk is pas iets meer dan een decennium oud, maar de computers op zakformaat die het hart van die maatschappelijke transformatie vormen, zijn alleen echt mogelijk dankzij een andere technologie:lithium-ionbatterijen.
Voor het eerst commercieel verkocht in 1991 door Sony voor zijn camcorders, dit soort batterijen zijn goed voor veel meer dan draagbare consumentenelektronica. Ze vormen het middelpunt van twee andere technologische revoluties met de kracht om de samenleving te transformeren:de overgang van verbrandingsmotoren naar elektrische voertuigen, en de verschuiving van een elektriciteitsnet dat wordt aangedreven door fossiele brandstoffen naar generatoren van hernieuwbare energie die overtollige elektriciteit opslaan in batterijen voor toekomstig gebruik.
Dus hoe werken deze batterijen? Wetenschappers en ingenieurs hebben hun hele loopbaan geprobeerd om betere batterijen te bouwen en er zijn nog steeds mysteries die we niet volledig begrijpen. Het verbeteren van batterijen vereist dat scheikundigen en natuurkundigen kijken naar veranderingen op atomair niveau, evenals mechanische en elektrische ingenieurs die de batterijpakketten kunnen ontwerpen en assembleren die apparaten van stroom voorzien. Als materiaalwetenschapper aan de Universiteit van Washington en Pacific Northwest National Lab, mijn werk heeft geholpen bij het verkennen van nieuwe materialen voor lithium-luchtbatterijen, magnesiumbatterijen en natuurlijk lithium-ionbatterijen.
Laten we eens kijken naar een dag in het leven van twee elektronen. We noemen een van hen Alex en hij heeft een vriend genaamd George.
Batterij anatomie
Alex leeft in een standaard alkaline AA-batterij, zoals in je zaklamp of afstandsbediening. Binnen een AA-batterij, er is een compartiment gevuld met zink en een ander gevuld met mangaanoxide. Aan een einde, het zink hangt maar zwak aan elektronen zoals Alex. Aan de andere kant, het mangaanoxide trekt krachtig elektronen naar zich toe. Tussenin, voorkomen dat de elektronen rechtstreeks van de ene naar de andere kant gaan, is een stuk papier gedrenkt in een oplossing van kalium en water, die naast elkaar bestaan als positieve kaliumionen en negatieve hydroxide-ionen.
Wanneer de batterij in een apparaat wordt geplaatst en wordt ingeschakeld, het interne circuit van het apparaat is voltooid. Alex wordt uit het zink gehaald, door het circuit en in het mangaanoxide. Onderweg, zijn beweging drijft het apparaat aan, of gloeilamp of wat dan ook is aangesloten op de batterij. Als Alex vertrekt, hij kan niet terugkomen:het zink dat een elektron heeft verloren, bindt zich met het hydroxide om zinkoxide te vormen. Deze verbinding is extreem stabiel en kan niet gemakkelijk weer worden omgezet in zink.
Aan de andere kant van de batterij, het mangaanoxide haalt een zuurstofatoom uit het water en laat hydroxide-ionen achter om het hydroxide dat door het zink wordt verbruikt in evenwicht te brengen. Zodra alle buren van Alex het zink hebben verlaten en zijn overgestapt op het mangaanoxide, de batterij is leeg en moet worden gerecycled.
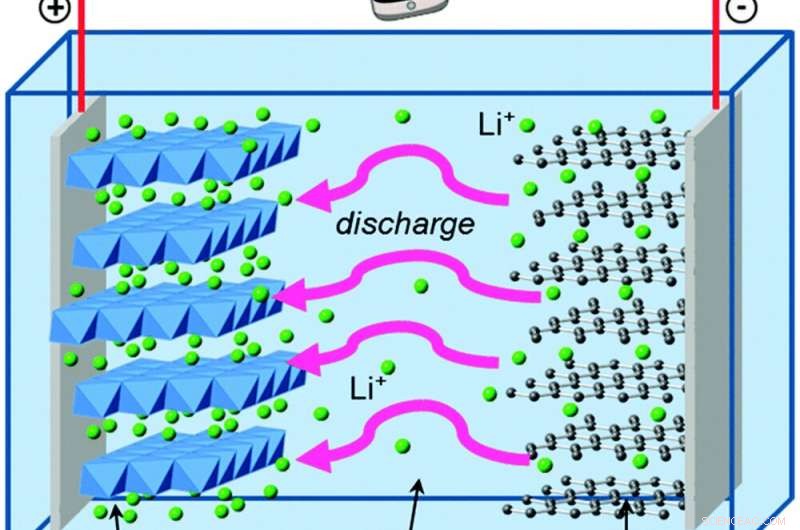
Terwijl elektronen buiten de batterij bewegen, lithiumionen bewegen erin om het elektrische evenwicht te behouden. Krediet:Islam en Fisher, Chemische Vereniging beoordelingen, 2014., CC BY
Voordelen van lithium-ion
Laten we dit vergelijken met George, die in een lithium-ionbatterij leeft. Lithium-ionbatterijen hebben dezelfde basisbouwstenen als alkaline AA-cellen, met enkele verschillen die grote voordelen opleveren.
George leeft in grafiet, wat zelfs zwakker is dan zink om elektronen vast te houden. En het andere deel van zijn batterij is lithium-kobaltoxide, die veel krachtiger elektronen aantrekt dan mangaanoxide - waardoor zijn batterij veel meer energie kan opslaan in dezelfde hoeveelheid ruimte dan een alkalinebatterij. De oplossing die het grafiet en lithiumkobaltoxide scheidt, bevat positief geladen lithiumionen, die gemakkelijk chemische bindingen vormen en verbreken als de batterij wordt ontladen en opgeladen.
Die chemische reacties zijn omkeerbaar, in tegenstelling tot de vorming van zinkoxide, dat is wat de elektronen en de lithiumionen heen en weer laat stromen over vele cycli van opladen en ontladen.
Dit proces is niet 100% efficiënt, hoewel - alle batterijen verliezen uiteindelijk hun vermogen om energie vast te houden. Hoe dan ook, de familie van Li-ion-chemie is krachtig genoeg geweest om vandaag de dag de batterijtechnologie te domineren.
Dit artikel is opnieuw gepubliceerd vanuit The Conversation onder een Creative Commons-licentie. Lees het originele artikel. 
 Simulaties maken het mogelijk om stereochemie te kiezen voor je eigen avontuur
Simulaties maken het mogelijk om stereochemie te kiezen voor je eigen avontuur Waarom vormen de meeste atomen chemische bindingen?
Waarom vormen de meeste atomen chemische bindingen?  Hoe ingesloten radicalen uit carboxyl te bevrijden?
Hoe ingesloten radicalen uit carboxyl te bevrijden? Onderzoekers testen Lamborghini's koolstofvezelmaterialen in de ruimte
Onderzoekers testen Lamborghini's koolstofvezelmaterialen in de ruimte Nieuwe microscoop vestigt een record voor het visualiseren van oppervlaktebevochtigende eigenschappen
Nieuwe microscoop vestigt een record voor het visualiseren van oppervlaktebevochtigende eigenschappen
 Droge zomer van 2018:een tiende van de bossen in Midden-Europa verloor te vroeg bladeren
Droge zomer van 2018:een tiende van de bossen in Midden-Europa verloor te vroeg bladeren Door NASA geleide campagne bestudeert de iconische vulkanen van Hawaï
Door NASA geleide campagne bestudeert de iconische vulkanen van Hawaï Video:Wat kan orkaan Irma ons vertellen over de toekomst van Atlantische orkanen?
Video:Wat kan orkaan Irma ons vertellen over de toekomst van Atlantische orkanen? Wanneer krijg je zeester op het strand?
Wanneer krijg je zeester op het strand?  De krachten achter de extreem hete zomer in Zuid- en Centraal-China
De krachten achter de extreem hete zomer in Zuid- en Centraal-China
Hoofdlijnen
- Onze darmmicroben hebben circadiane ritmes,
- Waarom blijven liedjes in mijn hoofd hangen?
- Wanneer is lachen een medisch symptoom?
- Waarom wordt magnesiumchloride gebruikt in PCR?
- Welke soorten cellen delen door mitose en cytokinese?
- Belangrijke soorten bacteriën
- Staan we allemaal af van een gemeenschappelijke vrouwelijke voorouder?
- Hoe werken het ademhalings- en cardiovasculaire systeem samen?
- Nieuwe statistische methode voor het evalueren van reproduceerbaarheid in studies van genoomorganisatie
- Meten:ONR-technologie zorgt ervoor dat piloten en vliegtuigen perfect bij elkaar passen

- Videogamefanaten met een jeukende hit Twitch

- Naarmate winkels zonder contant geld groeien, dat geldt ook voor de terugslag

- Toekomst van mobiliteit:enkele wilde ritten vooruit op tech show

- Verdwenen in 6 minuten:een laatste reis van een Ethiopian Airlines jet

 Wat kunnen we doen om onze schonere lucht te behouden?
Wat kunnen we doen om onze schonere lucht te behouden? Wat zijn de vijf onderverdelingen van koninkrijken?
Wat zijn de vijf onderverdelingen van koninkrijken?  Gerichte medicijnafgifte met deze nanodeeltjes kan medicijnen effectiever maken
Gerichte medicijnafgifte met deze nanodeeltjes kan medicijnen effectiever maken De Arctische koolstofcyclus versnelt, studieverslagen
De Arctische koolstofcyclus versnelt, studieverslagen Nieuwe bloeddruk-app en hardware wedijveren met nauwkeurigheid armmanchet
Nieuwe bloeddruk-app en hardware wedijveren met nauwkeurigheid armmanchet Klimaatverandering zal bosbranden voeden:experts
Klimaatverandering zal bosbranden voeden:experts Hackers richten zich op smartphones om cryptocurrencies te minen
Hackers richten zich op smartphones om cryptocurrencies te minen Unieke manieren om een DNA-model te bouwen
Unieke manieren om een DNA-model te bouwen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

