
Wetenschap
Soild natriumchloride wordt een ionische vaste stof genoemd. De voorspelde eigenschappen zijn wat?
Fysieke eigenschappen:
* Hoog smeltpunt en kookpunt: Sterke elektrostatische krachten houden de ionen stevig tegen elkaar in een kristalrooster, waardoor een aanzienlijke hoeveelheid energie nodig is om deze bindingen te verbreken.
* Hard en bros: De rigide roosterstructuur maakt het vaste, maar ook bros, omdat de ionen alleen in specifieke richtingen kunnen bewegen. Een sterke kracht kan de roosterstructuur verstoren, waardoor de vaste stof breuk.
* Slechte elektrische geleidbaarheid in vaste toestand: De ionen zijn vast in hun posities in het rooster, zodat ze niet vrij kunnen bewegen om elektrische stroom te dragen.
* Goede elektrische geleidbaarheid in gesmolten of opgeloste toestand: Wanneer gesmolten of opgelost, worden de ionen vrij om te bewegen, waardoor het materiaal elektriciteit kan leiden.
* Oplosbaarheid in polaire oplosmiddelen: Ionische verbindingen hebben de neiging om op te lossen in polaire oplosmiddelen zoals water omdat de polaire oplosmiddelmoleculen de ionen kunnen omringen en scheiden, waardoor de ionische bindingen worden verzwakt.
chemische eigenschappen:
* Hoge reactiviteit: Ionische verbindingen zijn vaak zeer reactief vanwege de aanwezigheid van geladen ionen die gemakkelijk kunnen deelnemen aan chemische reacties.
* elektrolyse: Wanneer gesmolten of in oplossing, kunnen ionische verbindingen worden ontleed door elektrolyse, waarbij de elektrische stroom de ionen naar de elektroden drijft.
Extra punten:
* kristallijne structuur: Ionische verbindingen hebben een goed gedefinieerde, regelmatige opstelling van ionen in een kristalrooster.
* Hydratatie: Sommige ionische verbindingen kunnen gehydrateerde zouten vormen wanneer ze watermoleculen absorberen. Dit beïnvloedt hun oplosbaarheid en andere eigenschappen.
Onthoud: Dit zijn algemene voorspellingen en specifieke eigenschappen kunnen enigszins variëren, afhankelijk van de specifieke ionische verbinding.
 Nieuwe studie vindt dat de natuur van vitaal belang is om klimaatverandering te verslaan
Nieuwe studie vindt dat de natuur van vitaal belang is om klimaatverandering te verslaan Bevriezende regen feiten
Bevriezende regen feiten  Pas uitgekomen Florida-zeeschildpadden consumeren gevaarlijke hoeveelheden drijvend plastic
Pas uitgekomen Florida-zeeschildpadden consumeren gevaarlijke hoeveelheden drijvend plastic Hoe helpt het gedrag van deeltjes in materie ons de natuur te begrijpen?
Hoe helpt het gedrag van deeltjes in materie ons de natuur te begrijpen?  Wat houdt meer warmte natte grond of droog vast en waarom?
Wat houdt meer warmte natte grond of droog vast en waarom?
Hoofdlijnen
- Commentaar:Kan de dikhoorn uit de Sierra Nevada het uitsterven ontwijken? Het kan betekenen dat je een ander wild dier in bedwang moet houden
- Waarom worden cellen de basiseenheid van het leven genoemd?
- Hoe de genoomdiversiteit van belangrijke gewassen hun evolutie vertelt
- Chimpansees passen insecten toe op wonden, een mogelijk geval van medicijngebruik?
- Uit onderzoek blijkt waarom de zebra zijn strepen kreeg
- Wat zijn twee lipidenfuncties?
- Zijn koralen genetisch uitgerust om de klimaatverandering te overleven?
- Wat gebruiken cellen om stoffen te transporteren?
- Zijn er eiwitten met een tertiaire structuur?
- Fruitig met een vleugje schimmel:hoe schimmelinfecties het aroma van wijn veranderen

- Succesvolle toepassing van machine learning bij de ontdekking van nieuwe polymeren
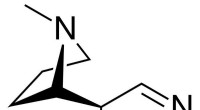
- Nicotines houden vast:wat hebben de darmen en het geslacht ermee te maken?
- Nieuwe productietechniek kan veelvoorkomend probleem in printtechnologie verbeteren
- Nieuw inzicht in de moleculaire wapens van het plantenmicrobioom
 Ontdekking van oude werktuigen in China suggereert dat mensen Afrika eerder hebben verlaten dan eerder werd gedacht
Ontdekking van oude werktuigen in China suggereert dat mensen Afrika eerder hebben verlaten dan eerder werd gedacht Wat zijn alkaanvloeistoffen die continue ketens vormen?
Wat zijn alkaanvloeistoffen die continue ketens vormen?  Wat maakt iets solide?
Wat maakt iets solide?  Waarmee verbindt cesium?
Waarmee verbindt cesium?  Wat bepaalt de overgrote meerderheid van de kenmerken van een atoom?
Wat bepaalt de overgrote meerderheid van de kenmerken van een atoom?  Hoe breng je elektromagnetische straling over in chemische energie?
Hoe breng je elektromagnetische straling over in chemische energie?  Overwinning voor Amerikaanse astronauten op kritieke ruimtewandeling om powerbox te vervangen (update)
Overwinning voor Amerikaanse astronauten op kritieke ruimtewandeling om powerbox te vervangen (update) Australië heeft meer inheemse vogelsoorten dan waar dan ook. Wat leidde tot deze explosie van diversiteit?
Australië heeft meer inheemse vogelsoorten dan waar dan ook. Wat leidde tot deze explosie van diversiteit?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

