
Wetenschap
Waarmee verbindt cesium?
Niet-metalen:
* halogenen: Cesium vormt gemakkelijk ionische bindingen met halogenen (fluor, chloor, broom, jodium en astatine) om zouten zoals CSF (cesiumfluoride), CSCL (cesiumchloride), CSBR (cesiumbromide), csi (cesium iodide) te creëren.
* zuurstof: Cesium vormt het oxide CS₂O (cesiumoxide) en andere oxiden zoals CS₂O₂ en CSO₂.
* zwavel: Cesium kan sulfiden vormen zoals CS₂S (cesiumsulfide).
* stikstof: Cesium kan nitriden vormen zoals CS₃N (cesiumnitride).
* Phosporus: Cesium kan fosfiden vormen zoals CS₃P (cesiumfosfide).
Andere metalen:
* Intermetallische verbindingen: Cesium kan intermetallische verbindingen vormen met andere metalen, zoals legeringen met goud, kwik en andere alkali -metalen.
Andere overwegingen:
* Reactiviteit: Cesium is het meest reactieve alkalimetaal, wat betekent dat het krachtig reageert met water en zelfs explodeert wanneer het wordt blootgesteld aan lucht. Dit maakt het hanteren uiterst gevaarlijk en vereist gespecialiseerde procedures.
* ionische bindingen: Cesium vormt voornamelijk ionische bindingen, waar het zijn elektron gemakkelijk doneert om een positief ion te vormen en elektrostatisch interageert met een negatief geladen ion.
* Covalente bindingen: Hoewel minder gebruikelijk, kan cesium deelnemen aan covalente binding met sommige niet-metalen onder specifieke omstandigheden.
Gebruik:
De hoge reactiviteit van cesium beperkt zijn praktische toepassingen. Het vindt echter gebruik in:
* atomaire klokken: Caesium-133 is de standaard voor het definiëren van de tweede in atomaire klokken vanwege de stabiele en precieze atomaire overgangen.
* onderzoek: Cesium wordt gebruikt in verschillende onderzoekstoepassingen vanwege de unieke eigenschappen.
Samenvattend: Cesium bindt voornamelijk met niet-metalen door ionische interacties om zouten en oxiden te vormen. Het kan ook intermetallische verbindingen vormen met andere metalen. Vanwege de hoge reactiviteit vereist cesium gespecialiseerde behandeling en wordt hij voornamelijk gebruikt in wetenschappelijke en onderzoekstoepassingen.
 Welk bewijs heb je dat het evenwicht verschoof toen de verzadigde kaliumnitraatoplossing werd afgekoeld?
Welk bewijs heb je dat het evenwicht verschoof toen de verzadigde kaliumnitraatoplossing werd afgekoeld?  Wat is de chemische vergelijking ethyljodide plus aq.KOH?
Wat is de chemische vergelijking ethyljodide plus aq.KOH?  Eenvoudige methode om te bepalen of noten en zuivelproducten gif bevatten
Eenvoudige methode om te bepalen of noten en zuivelproducten gif bevatten Een suikeroplossing van 20% maken
Een suikeroplossing van 20% maken Nieuwe inzichten kunnen de ontwikkeling van natuurlijke en veiligere fungiciden bevorderen
Nieuwe inzichten kunnen de ontwikkeling van natuurlijke en veiligere fungiciden bevorderen
 Olie belemmert het vermogen van koraalrifvissen om huizen te vinden en roofdieren te ontwijken
Olie belemmert het vermogen van koraalrifvissen om huizen te vinden en roofdieren te ontwijken Hoe verhoudt een bodemhorizon zich tot profiel?
Hoe verhoudt een bodemhorizon zich tot profiel?  Het lokale bergklimaat wordt beïnvloed door de bladoppervlakteverhouding in de omliggende bossen
Het lokale bergklimaat wordt beïnvloed door de bladoppervlakteverhouding in de omliggende bossen Video:Wetenschappers onderzoeken oceaanstromingen door middel van supercomputersimulaties
Video:Wetenschappers onderzoeken oceaanstromingen door middel van supercomputersimulaties Wat is het gebruik van knopschilfers in houtachtige planten?
Wat is het gebruik van knopschilfers in houtachtige planten?
Hoofdlijnen
- CRISPR gebruiken om warmer te maken, minder vette varkens
- Wie heeft mannen nodig? Vrouwelijke haaien maken alleen baby's in Italië
- De ongelooflijke reis van de eerste Afrikaanse schildpad die in Europa aankwam
- Spiegelbeeldmoleculen onthullen droogtestress in bossen
- Gametes -sporen zijn het product van?
- Wat zijn de bepalende kenmerken van materie?
- Wat is het kleine verschil tussen objecten of organismen die hetzelfde basistype zijn?
- Wat zijn drie doelorganen van het parathyroïde hormoon?
- Studie maakt ingang naar landbouw zwanenhals zeepokken
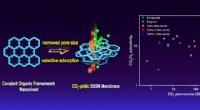
- Eenfasige covalente organische raamwerkmembranen maken CO2-selectieve scheiding mogelijk
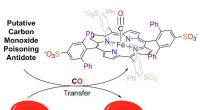
- Een remedie voor koolmonoxidevergiftiging ontgrendelen
- Een eenvoudige methode ontwikkeld voor 3D-biofabricage op basis van bacteriële cellulose

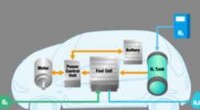
- Mobiliteit op waterstof komt dichterbij met brandstofcelsystemen van de volgende generatie
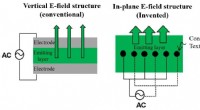
- In textielvezels ingebed multiluminescent apparaat voor toekomstige draagbare apparaten
 Nieuw ontdekte spookachtige cirkels in de lucht kunnen niet worden verklaard door de huidige theorieën, astronomen opgewonden
Nieuw ontdekte spookachtige cirkels in de lucht kunnen niet worden verklaard door de huidige theorieën, astronomen opgewonden Welke eenheid wordt gebruikt om de intensiteit van het geluid uit te drukken?
Welke eenheid wordt gebruikt om de intensiteit van het geluid uit te drukken?  De verschillen tussen mammoeten en olifanten
De verschillen tussen mammoeten en olifanten Wat gebeurt er op moleculair niveau wanneer er een evenwicht van vloeistofvapor bestaat?
Wat gebeurt er op moleculair niveau wanneer er een evenwicht van vloeistofvapor bestaat?  Kenmerken van een zebra
Kenmerken van een zebra  Wat is de textuur van arseen?
Wat is de textuur van arseen?  Wat is het verschil tussen energiebesparing en efficiëntie?
Wat is het verschil tussen energiebesparing en efficiëntie?  Fluorescerende nanodiamanten met succes geïnjecteerd in levende cellen
Fluorescerende nanodiamanten met succes geïnjecteerd in levende cellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

