
Wetenschap
Hoe NH4 NO2 NO3 Effect pH in water?
1. NH₄⁺ (ammoniumion)
* zuur: Ammoniumion (NH₄⁺) is het conjugaatzuur van ammoniak (NH₃). Het hydrolyseert in water, wat betekent dat het reageert met water om H⁺ -ionen vrij te maken:
`` `
NH₄⁺ (aq) + h₂o (l) ⇌ nH₃ (aq) + h₃o⁺ (aq)
`` `
* Effect op pH: De productie van H₃o⁺ (hydroniumionen) maakt de oplossing zuurder, waardoor de pH wordt verlaagd.
2. No₂⁻ (nitrite ion)
* Zwak basic: Nitrietion (NO₂⁻) is de conjugaatbasis van stikstofzuur (HNO₂). Het kan een proton van water accepteren, maar in veel mindere mate dan ammoniumionen:
`` `
No₂⁻ (aq) + h₂o (l) ⇌ hno₂ (aq) + oh⁻ (aq)
`` `
* Effect op pH: De kleine productie van OH⁻ (hydroxide -ionen) maakt de oplossing enigszins eenvoudig, waardoor de pH wordt verhoogd, maar het effect is veel minder uitgesproken dan de zuurgraad van ammoniumion.
3. No₃⁻ (nitraation)
* neutraal: Nitraation (NO₃⁻) is de conjugaatbasis van salpeterzuur (HNO₃). Tikstofzuur is echter een zeer sterk zuur. Het nitraation is zo zwak een basis dat het in wezen geen effect heeft op de pH van water.
Algemeen effect:
* NH₄NO₃ (ammoniumnitraat): Dit zout bevat zowel ammoniumion (NH₄⁺) als nitraation (NO₃⁻). Het zure effect van het ammoniumion domineert, wat resulteert in een zure oplossing.
* NH₄NO₂ (ammoniumnitriet): Dit zout bevat zowel ammoniumion (NH₄⁺) als nitrietion (NO₂⁻). Het zure effect van het ammoniumion zal domineren, waardoor de oplossing zuur is , maar het effect zal iets minder uitgesproken zijn dan met ammoniumnitraat vanwege de zwakke basiciteit van nitriet.
Belangrijke opmerking: De exacte pH -waarden van deze oplossingen zijn afhankelijk van de concentraties van de zouten.
 Is 2 3-Butanedione oplosbaar in water?
Is 2 3-Butanedione oplosbaar in water?  Wat zijn eigenschappen beschrijft hoe een stof omgaat met een andere stof?
Wat zijn eigenschappen beschrijft hoe een stof omgaat met een andere stof?  Hoeveel zuurstofatomen doet houtalcohol?
Hoeveel zuurstofatomen doet houtalcohol?  Is het oplossen van zout in water een fysieke of chemische verandering?
Is het oplossen van zout in water een fysieke of chemische verandering?  Verdampt zwavelzuur in combinatie met fluorwaterstof volledig bij hoge temperaturen?
Verdampt zwavelzuur in combinatie met fluorwaterstof volledig bij hoge temperaturen?
 Schotse rotsen blijken saai miljard was toch niet zo saai
Schotse rotsen blijken saai miljard was toch niet zo saai Afvalverzamelaars vrezen voor toekomst bij Senegalese megastortplaats
Afvalverzamelaars vrezen voor toekomst bij Senegalese megastortplaats Vernietiging door duizend sneden:de meedogenloze bedreiging die mijnbouw vormt voor het culturele landschap van Pilbara
Vernietiging door duizend sneden:de meedogenloze bedreiging die mijnbouw vormt voor het culturele landschap van Pilbara Waarschuwing tegen klimaatverandering van ingestorte oude steden
Waarschuwing tegen klimaatverandering van ingestorte oude steden Verbeterd beheer van gekweekte veengebieden kan 500 miljoen ton koolstofdioxide verminderen
Verbeterd beheer van gekweekte veengebieden kan 500 miljoen ton koolstofdioxide verminderen
Hoofdlijnen
- Wat is een Sugardoodle?
- Onderzoekers tonen bewijs van 'geheugen' in cellen en moleculen
- Wat welke koninkrijk prokaryoten?
- Wat is het proces waarin onze sensorische receptoren stimuli van de omgeving omzetten in een vorm die kan worden verzonden naar en gebruikt door de hersenen?
- Welke wetenschapper gebruikte tuinwten om overervingspatronen te testen?
- Zeer uiteenlopende skinks bieden inzicht in hoe evolutie werkt
- DNA wordt vaak gebruikt bij het oplossen van misdaden. Maar hoe werkt profilering eigenlijk?
- Hoe klimaatverandering planten zal beïnvloeden
- Onderzoekers laten zien hoe het ontwerp van gebouwen de bacteriën binnenshuis beïnvloedt
- Studie van zouten in water die opschudding veroorzaken

- Een ontbrekende schakel van methaan naar methanol blootleggen

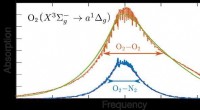
- Onderzoekers ontdekken hoe botsende zuurstofmoleculen licht absorberen
- De tijd die nodig is om de belangrijkste moleculen te sequensen, kan worden teruggebracht van jaren tot minuten
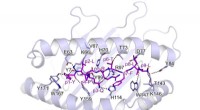
- Ontdekken hoe T-cellen het SARS-COV-2 virus spike-eiwit herkennen
 Zitten tektonische platen op het oppervlak van de mantel?
Zitten tektonische platen op het oppervlak van de mantel?  Wat is water in scheuren en poreuze rotsformaties ondergronds?
Wat is water in scheuren en poreuze rotsformaties ondergronds?  Hoe zien zonnepanelen eruit?
Hoe zien zonnepanelen eruit?  Wat is de inhoud van de cel?
Wat is de inhoud van de cel?  Een katalysator één atoom tegelijk afbeelden
Een katalysator één atoom tegelijk afbeelden De beweging van een enkel nanodeeltje volgen
De beweging van een enkel nanodeeltje volgen Wat zijn het proces en de machines die nodig zijn om steenkool uit de lithosfeer te halen?
Wat zijn het proces en de machines die nodig zijn om steenkool uit de lithosfeer te halen?  Wat zijn de karakteristieke eigenschappen van materie?
Wat zijn de karakteristieke eigenschappen van materie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

