
Wetenschap
Hoe worden chloride -ionen gemaakt?
Hier is een uitsplitsing:
* chlooratoom: Een chlooratoom heeft 17 elektronen. De elektronische configuratie is 2, 8, 7. Dit betekent dat het 7 elektronen in de buitenste schaal heeft, waardoor het zeer reactief is.
* ionisatie: Wanneer een chlooratoom een elektron krijgt, wordt het een chloride -ion. Dit elektron vult de buitenste schaal, waardoor het een stabiele elektronische configuratie van 2, 8, 8 heeft.
Het proces kan worden weergegeven door de volgende vergelijking:
CL + E- → Cl-
Waar:
* CL vertegenwoordigt een chlooratoom
* e- vertegenwoordigt een elektron
* Cl- vertegenwoordigt een chloride-ion
Gemeenschappelijke manieren waarop chloride -ionen worden gevormd:
* ionische binding: Wanneer chloor reageert met een metaal, krijgt het een elektron van het metaalatoom en vormt het een chloride -ion. Dit resulteert in een ionische binding, waarbij het metaalkation en de chloride -anion elkaar aantrekken.
* Oplostzouten: Veel zouten, zoals natriumchloride (NaCl), bevatten chloride -ionen. Wanneer deze zouten in water worden opgelost, dissociëren de chloride -ionen van het zout en worden ze vrij in oplossing.
Chloride-ionen zijn essentieel voor veel biologische processen, waaronder het handhaven van vloeistofbalans, zenuwimpulsoverdracht en zuur-base-balans.
 Wat is bi-axiaal georiënteerd polyethyleentereftalaat?
Wat is bi-axiaal georiënteerd polyethyleentereftalaat?  Wat is de totale massa water gevormd wanneer 8 gram waterstof volledig reageert met 64 ovygen?
Wat is de totale massa water gevormd wanneer 8 gram waterstof volledig reageert met 64 ovygen?  De ontdekking van vloeibaar metaal luidt een nieuwe golf van chemie en elektronica in
De ontdekking van vloeibaar metaal luidt een nieuwe golf van chemie en elektronica in Welke objecten bevatten gas?
Welke objecten bevatten gas?  Wat maken calcium en zuurstof als ze reageren?
Wat maken calcium en zuurstof als ze reageren?
 Klimaatcatastrofe is al eerder gebeurd - en het leert ons over de toekomst
Klimaatcatastrofe is al eerder gebeurd - en het leert ons over de toekomst Diverse geografie van de 82 grootste eilanden van Groot-Brittannië onthuld
Diverse geografie van de 82 grootste eilanden van Groot-Brittannië onthuld Zullen in 2070 echt drie miljard mensen leven in temperaturen die zo heet zijn als de Sahara?
Zullen in 2070 echt drie miljard mensen leven in temperaturen die zo heet zijn als de Sahara? Hoe hergebruikt de natuurmaterialen?
Hoe hergebruikt de natuurmaterialen?  Nieuwe tool voor vroege detectie van blauwalgen
Nieuwe tool voor vroege detectie van blauwalgen
Hoofdlijnen
- Hoe kunnen slechts 4 basen in rna instructies bevatten voor 20 aminozuren?
- Wat is de vorm van cellen gevonden in stengels?
- Welke soorten bewijs gebruiken wetenschappers om een organisme op een fylogene boom te plaatsen en wat vertelt die plaats je?
- Virtuele Labrador kan onderzoekers helpen bij het aanpakken van hondenbeten
- Welke cel slaat waterafvalproducten op voedsel en andere cellulaire materialen?
- Waarom worden sommige aminozuren essentiële aminozuren genoemd?
- Wat is het fenomeen engelenhaar?
- Een onderzoeker uit de staat Iowa bestudeert hoe enzymen cellulose afbreken
- Waar wordt het erfelijke materiaal van de cel vastgehouden?
- Wetenschappers bouwen M29-clustermodelkatalysator
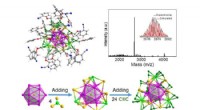
- Bacteriën helpen bij het maken van caloriearme suiker

- Nieuwe studie levert bewijs voor decennia-oude theorie om het vreemde gedrag van water te verklaren

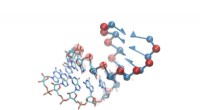
- De structuur van RNA ontdekken
- Harde magneten met één molecuul:tetranucleaire zeldzame aardmetaalcomplexen met gigantische spin

 Hoe is de beweging van deeltjes in een vloeistof die verschilt van de deeltjes vast?
Hoe is de beweging van deeltjes in een vloeistof die verschilt van de deeltjes vast?  Planten zijn afhankelijk van de atmosfeer als grootste bron van?
Planten zijn afhankelijk van de atmosfeer als grootste bron van?  Zijn krachten altijd resulterend in beweging?
Zijn krachten altijd resulterend in beweging?  Oude muizen ontdekt door klimaatgrotten
Oude muizen ontdekt door klimaatgrotten Betoverende animatie van de zeewatertemperatuur van 2016
Betoverende animatie van de zeewatertemperatuur van 2016 In het nummer 234567 Welk cijfer is 10 duizend?
In het nummer 234567 Welk cijfer is 10 duizend?  Hoe kun je Roadrunners
Hoe kun je Roadrunners Coronavirus-nieuwsmoeheid begint te bijten voor Australiërs in lockdown
Coronavirus-nieuwsmoeheid begint te bijten voor Australiërs in lockdown
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

