
Wetenschap
Nieuwe studie levert bewijs voor decennia-oude theorie om het vreemde gedrag van water te verklaren

Een nieuwe studie van Princeton University en Sapienza University of Rome levert sterk bewijs voor een controversiële theorie dat water bij zeer lage temperaturen in twee verschillende vloeibare vormen kan bestaan:de ene is minder dicht en meer gestructureerd dan de andere. Krediet:Foto door John Salatas, Creative Commons-licentie
Water, zo gewoon en zo essentieel voor het leven, handelt op een manier die voor wetenschappers nogal raadselachtig is. Bijvoorbeeld, waarom is ijs minder dicht dan water, drijven in plaats van zinken zoals andere vloeistoffen doen als ze bevriezen?
Nu levert een nieuwe studie sterk bewijs voor een controversiële theorie dat water bij zeer lage temperaturen in twee verschillende vloeibare vormen kan bestaan:de ene is minder dicht en meer gestructureerd dan de andere.
Onderzoekers van Princeton University en Sapienza University of Rome hebben computersimulaties van watermoleculen uitgevoerd om het kritieke punt te ontdekken waarop de ene vloeibare fase in de andere overgaat. Het onderzoek is deze week gepubliceerd in het tijdschrift Wetenschap .
"De aanwezigheid van het kritieke punt biedt een heel eenvoudige verklaring voor de eigenaardigheden van water, " zei Princeton's decaan voor onderzoek Pablo Debenedetti, the Class of 1950 Professor in Engineering and Applied Science, en hoogleraar chemische en biologische technologie. "Het vinden van het kritieke punt is gelijk aan het vinden van een goed, eenvoudige verklaring voor de vele dingen die water vreemd maken, vooral bij lage temperaturen."
De eigenaardigheden van water zijn dat als water afkoelt, het breidt zich uit in plaats van te krimpen, daarom is bevroren water minder dicht dan vloeibaar water. Water wordt ook meer samendrukbaar - of samendrukbaar - bij lagere temperaturen. Er zijn ook minstens 17 manieren waarop de moleculen kunnen rangschikken wanneer ze bevroren zijn.
Een kritiek punt is een unieke waarde van temperatuur en druk waarbij twee fasen van materie niet meer van elkaar te onderscheiden zijn, en het vindt plaats net voordat materie van de ene fase in de andere overgaat.
De eigenaardigheden van water zijn gemakkelijk te verklaren door de aanwezigheid van een kritisch punt, zei Debenedetti. De aanwezigheid van een kritisch punt wordt gevoeld op de eigenschappen van de stof vrij ver weg van het kritieke punt zelf. Op het kritieke punt, de samendrukbaarheid en andere thermodynamische maatregelen van hoe de moleculen zich gedragen, zoals de warmtecapaciteit, zijn oneindig.
Met behulp van twee verschillende rekenmethoden en twee zeer realistische computermodellen van water, het team identificeerde het vloeistof-vloeistof kritieke punt als liggend in een bereik van ongeveer 190 tot 170 graden Kelvin (ongeveer -117 graden tot -153 graden Fahrenheit) bij ongeveer 2, 000 keer de atmosferische druk op zeeniveau.
De detectie van het kritieke punt is een bevredigende stap voor onderzoekers die betrokken zijn bij de decennia-oude zoektocht naar de onderliggende fysieke verklaring voor de ongebruikelijke eigenschappen van water. Enkele decennia geleden, natuurkundigen theoretiseerden dat het koelen van water tot temperaturen onder het vriespunt, terwijl het als een vloeistof wordt gehandhaafd - een "onderkoelde" toestand die voorkomt in wolken op grote hoogte - de twee unieke vloeibare vormen van water bij voldoende hoge druk zou blootstellen.
Om de theorie te testen, onderzoekers wendden zich tot computersimulaties. Experimenten met echte watermoleculen hebben tot nu toe geen eenduidig bewijs geleverd voor een kritiek punt, gedeeltelijk te wijten aan de neiging van onderkoeld water om snel tot ijs te bevriezen.
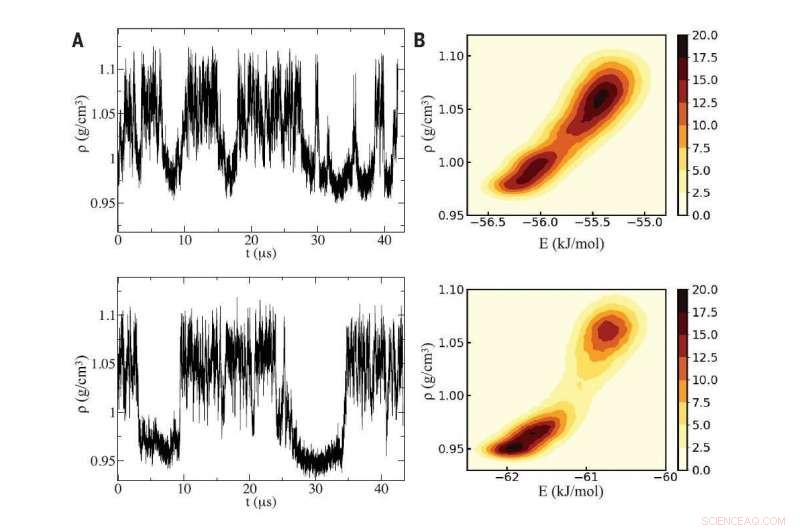
Fig A (links):Met behulp van twee verschillende computersimulaties van water (boven- en onderpanelen), onderzoekers ontdekten schommelingen in dichtheid die kenmerkend zijn voor onderkoeld water dat oscilleert tussen twee vloeibare fasen die verschillen in dichtheid. Fig B (rechts):De simulaties onthulden een kritisch punt tussen de twee vloeistoffasen, waarvan de verschillende dichtheden microscopisch hun oorsprong vinden in het binnendringen van een extra watermolecuul in de lokale omgeving van een generiek centraal molecuul in de vloeistof met hoge dichtheid. Credit:herdrukt met toestemming van PG Debenedetti et al, Wetenschap Deel 369, uitgave 6501, DOI:10.1126/science.abb9796
Francesco Sciortino, een professor in de natuurkunde aan de Sapienza Universiteit van Rome, voerde in 1992 als postdoctoraal onderzoeker een van de eerste dergelijke modelstudies uit. gepubliceerd in het tijdschrift Natuur , was de eerste die het bestaan van een kritisch punt tussen de twee vloeibare vormen suggereerde.
De nieuwe bevinding is buitengewoon bevredigend voor Sciortino, die ook co-auteur is van de nieuwe studie in Wetenschap . De nieuwe studie gebruikte de veel snellere en krachtigere onderzoekscomputers van vandaag en nieuwere en nauwkeurigere modellen van water. Zelfs met de krachtige onderzoekscomputers van vandaag, de simulaties namen ongeveer 1,5 jaar rekentijd in beslag.
"Je kunt je de vreugde voorstellen toen we de kritieke fluctuaties begonnen te zien die zich precies gedroegen zoals ze zouden moeten, " zei Sciortino. "Nu kan ik goed slapen, want na 25 jaar mijn oorspronkelijke idee is bevestigd."
In het geval van de twee vloeibare vormen van water, de twee fasen bestaan naast elkaar in een ongemakkelijk evenwicht bij temperaturen onder het vriespunt en bij voldoende hoge drukken. Naarmate de temperatuur daalt, de twee vloeibare fasen gaan touwtrekken totdat er een wint en de hele vloeistof een lage dichtheid krijgt.
In de simulaties uitgevoerd door postdoctoraal onderzoeker Gül Zerze aan Princeton en Sciortino in Rome, omdat ze de temperatuur ver onder het vriespunt naar het onderkoelde bereik brachten, de dichtheid van water fluctueerde wild, net zoals voorspeld.
Sommige van de vreemde gedragingen van water liggen waarschijnlijk achter de levengevende eigenschappen van water, zei Zerze. "De vloeistof van het leven is water, maar we weten nog steeds niet precies waarom water niet vervangbaar is door een andere vloeistof. We denken dat de reden te maken heeft met het abnormale gedrag van water. Andere vloeistoffen vertonen dat gedrag niet, dus dit moet worden gekoppeld aan water als de vloeistof van het leven."
De twee fasen van water treden op omdat de vorm van het watermolecuul kan leiden tot twee manieren om samen te pakken. In de vloeistof met een lagere dichtheid, vier moleculen clusteren rond een centraal vijfde molecuul in een geometrische vorm die een tetraëder wordt genoemd. In de vloeistof met hogere dichtheid, een zesde molecuul perst naar binnen, wat tot gevolg heeft dat de lokale dichtheid toeneemt.
Het team ontdekte het kritieke punt in twee verschillende computermodellen van water. Voor elk model, de onderzoekers onderwierpen de watermoleculen aan twee verschillende computationele benaderingen om naar het kritieke punt te zoeken. Beide benaderingen leverden de bevinding van een kritisch punt op.
Peter Pool, een professor in de natuurkunde aan de St. Francis Xavier University in Canada, en een afgestudeerde student toen hij samenwerkte met Sciortino en co-auteur was van het artikel uit 1992 in Nature, zei dat het resultaat bevredigend was. "Het is heel geruststellend om dit nieuwe resultaat te hebben, " zei hij. "Sinds 1992 is het lang en soms eenzaam wachten geweest om een ander ondubbelzinnig geval van een vloeistof-vloeistoffaseovergang in een realistisch watermodel te zien."
C. Austen Angell, Regenten Professor aan de Arizona State University, is een van de pioniers van experimenten in de jaren 70 met de aard van onderkoeld water. "Dit is ongetwijfeld een heroïsche poging in de simulatie van waterfysica met een zeer interessant, en welkom, conclusie, " zei Angel, die niet betrokken was bij het huidige onderzoek, in een e-mail. "Als experimentator met toegang tot fysieke evenwichtsmetingen (op lange termijn) op echt water, Ik had me altijd 'veilig' gevoeld tegen bevoordeling door computersimulators. Maar de gegevens die in het nieuwe artikel worden gepresenteerd, laten zien dat dit niet langer waar is."
 Zelfassemblage van zeer poreuze kristallijne deeltjes tot nieuwe fotonische materialen voor detectietoepassingen
Zelfassemblage van zeer poreuze kristallijne deeltjes tot nieuwe fotonische materialen voor detectietoepassingen Nieuwe materialen verbeteren de levering van therapeutisch boodschapper-RNA
Nieuwe materialen verbeteren de levering van therapeutisch boodschapper-RNA Brandstof van afgedankte banden
Brandstof van afgedankte banden Wetenschappers ontwerpen moleculair systeem voor kunstmatige fotosynthese
Wetenschappers ontwerpen moleculair systeem voor kunstmatige fotosynthese Biomaterialen met Frankenstein-eiwitten helpen weefsel te genezen
Biomaterialen met Frankenstein-eiwitten helpen weefsel te genezen
 Zwaartekrachtgolfinzichten van internetstralende ballonnen
Zwaartekrachtgolfinzichten van internetstralende ballonnen Eenvoudige en eenvoudige Science Fair-projecten
Eenvoudige en eenvoudige Science Fair-projecten  Een klimaat in crisis vraagt om investeringen in directe luchtafvang, nieuws onderzoek vindt
Een klimaat in crisis vraagt om investeringen in directe luchtafvang, nieuws onderzoek vindt Energie die wordt losgelaten door onderzeese vulkanen kan een continent van stroom voorzien
Energie die wordt losgelaten door onderzeese vulkanen kan een continent van stroom voorzien Hoe bouw je een oude Egyptische tombe voor een schoolproject
Hoe bouw je een oude Egyptische tombe voor een schoolproject
Hoofdlijnen
- Haaienvinnenverboden helpen haaien misschien niet, wetenschappers zeggen:
- Biologen op het spoor van hersenetende amoeben
- Studie belicht de instandhoudingsbehoeften van recent ontdekte vissoorten in Southwest Virginia
- Onderzoeker rapporteert belangrijke componenten van antivirale verdediging van honingbijen
- Voor het eerst hebben wetenschappers levende bacteriën rechtstreeks waargenomen in poolijs en sneeuw
- Wat zou er gebeuren als een cel geen Golgi-lichamen had?
- De voor- en nadelen van mutatie
- Is er een gen voor elke ziekte?
- Het leven van een albatros:individualiteit aanpakken in populatiestudies
- Nieuw kwantummateriaal kan waarschuwen voor neurologische aandoeningen

- Kunstmatige fotosynthesetechnologie in opkomst

- Prestaties van vaste katalysator voor methaanomzetting worden voorspeld door theoretische berekening
- Onderzoekers verkrijgen nieuwe resultaten over het corrosiegedrag van legeringsmaterialen onder extreme omgevingen
- Efficiënter omgaan met grondstoffen met behulp van moleculaire transportbanden
 Het internationale ruimtestation 20 biedt hoop en een sjabloon voor toekomstige samenwerking
Het internationale ruimtestation 20 biedt hoop en een sjabloon voor toekomstige samenwerking Enkele ongelabelde biomoleculen kunnen worden gedetecteerd door licht
Enkele ongelabelde biomoleculen kunnen worden gedetecteerd door licht psych! Hogescholen leren phishing les door hun eigen te targeten
psych! Hogescholen leren phishing les door hun eigen te targeten Horizontale asymptoten zoeken van een grafiek van een rationale functie
Horizontale asymptoten zoeken van een grafiek van een rationale functie Team ontwikkelt biotemplate ontwerp van piëzo-elektrische energieoogstapparaat
Team ontwikkelt biotemplate ontwerp van piëzo-elektrische energieoogstapparaat Ionotronische technologie waarvoor geen vloeibare elektrolyten nodig zijn
Ionotronische technologie waarvoor geen vloeibare elektrolyten nodig zijn Oceaantemperatuur als een vitaal teken dat de opwarming van de aarde onthult
Oceaantemperatuur als een vitaal teken dat de opwarming van de aarde onthult Hoe de kubuswortel te vinden in Ti-84
Hoe de kubuswortel te vinden in Ti-84
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

