
Wetenschap
Wat is de totale massa water gevormd wanneer 8 gram waterstof volledig reageert met 64 ovygen?
1. Begrijp de chemische reactie
Waterstof (H₂) reageert met zuurstof (O₂) om water te vormen (H₂o):
2h₂ + o₂ → 2h₂o
2. Moles berekenen
* waterstof:
- Molaire waterstofmassa (H₂) =2 g/mol
- mol waterstof =8 g / 2 g / mol =4 mol
* zuurstof:
- Molaire zuurstofmassa (o₂) =32 g/mol
- mol zuurstof =64 g / 32 g / mol =2 mol
3. Bepaal de beperkende reactant
De beperkende reactant is degene die eerst volledig wordt geconsumeerd, waardoor de hoeveelheid product wordt beperkt.
* van de evenwichtige vergelijking: 2 mol waterstof reageert met 1 mol zuurstof.
* We hebben: 4 mol waterstof en 2 mol zuurstof.
* Dit betekent: Zuurstof is de beperkende reactant omdat deze zal worden opgebruikt voordat alle waterstof wordt geconsumeerd.
4. Bereken de gevormde mol water
* van de evenwichtige vergelijking: 1 mol zuurstof produceert 2 mol water.
* Omdat we 2 mol zuurstof hebben: We zullen 2 mol zuurstof vormen * 2 mol water/mol zuurstof =4 mol water.
5. Bereken massa water
* watermassa (H₂o) =18 g/mol
* massa water =4 mol * 18 g/mol =72 g
Daarom is de totale massa water gevormd wanneer 8 gram waterstof volledig reageert met 64 gram zuurstof 72 gram.
 Het mechanisme van foto-geëxciteerde nucleobasen blootleggen:is verval snel of onderdrukt?
Het mechanisme van foto-geëxciteerde nucleobasen blootleggen:is verval snel of onderdrukt?  Onderzoekers ontwikkelen draagbaar apparaat dat in 10 minuten 3D-afbeeldingen van de huid maakt
Onderzoekers ontwikkelen draagbaar apparaat dat in 10 minuten 3D-afbeeldingen van de huid maakt Verschillend tussen organische verbinding van anorganisch volgens oplosbaarheid?
Verschillend tussen organische verbinding van anorganisch volgens oplosbaarheid?  Wat is de katalysator die in levende cellen wordt gevonden?
Wat is de katalysator die in levende cellen wordt gevonden?  Hoe kan een stof geen smeltpunt of kookpunt hebben?
Hoe kan een stof geen smeltpunt of kookpunt hebben?
 Sommige scholen in Pittsburgh zijn vandaag gesloten vanwege waterproblemen
Sommige scholen in Pittsburgh zijn vandaag gesloten vanwege waterproblemen Praying Mantis Feiten voor kinderen
Praying Mantis Feiten voor kinderen  Een beter begrip van de hoge niveaus van kwikvervuiling in de Arctische toendra
Een beter begrip van de hoge niveaus van kwikvervuiling in de Arctische toendra Crowd-sourced wetenschap werpt licht op hoe nieuwe soorten zich in ruimte en tijd vormen
Crowd-sourced wetenschap werpt licht op hoe nieuwe soorten zich in ruimte en tijd vormen  Je kunt je bord hebben en het ook opeten, zegt Poolse uitvinder
Je kunt je bord hebben en het ook opeten, zegt Poolse uitvinder
Hoofdlijnen
- Waarom wordt evolutie als theorie overgebracht?
- 'S Werelds botanische tuinen bevatten een derde van alle bekende plantensoorten, en help de meest bedreigde te beschermen
- Waarom is buffers belangrijk in biologische studies?
- Zit de helmknop in een mannelijk orgaan of in een vrouwelijke plant?
- Wat is een actief proces waarmee het plasmamembraan een invagenatie kan vormen?
- Wat komt voornamelijk uit de kerncel?
- Wat is de denaturatie van een eiwit?
- Waarom zou een wetenschapper de stap in de wetenschappelijke methode moeten herhalen?
- Een JELL-O-model van een diercel maken
- Biosensor maakt realtime zuurstofmonitoring mogelijk voor organen-op-een-chip

- Onderzoekers ontwikkelen smartphonelezer voor snellere infectietests

- Witte wijn, Combo met citroensap voorkomt ongewenste verkleuring van deeg

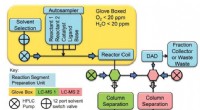
- Stroomapparaat bemonstert tot 1500 chemische reacties per dag
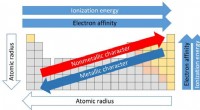
- Het periodiek systeem begrijpen door de lens van de vluchtige Groep I metalen
 Hoe wordt grond en gesteente genoemd waar water doorheen kan stromen?
Hoe wordt grond en gesteente genoemd waar water doorheen kan stromen?  Wat zijn de afkortingen voor vloeistofmetingen?
Wat zijn de afkortingen voor vloeistofmetingen?  De cellen die verantwoordelijk zijn voor het kleurenzien in de ogen van zoogdieren heten?
De cellen die verantwoordelijk zijn voor het kleurenzien in de ogen van zoogdieren heten?  Nieuwe goedkope techniek zet bulklegeringen om in oxide-nanodraden
Nieuwe goedkope techniek zet bulklegeringen om in oxide-nanodraden Wat zit er achter de stijgende gasprijzen
Wat zit er achter de stijgende gasprijzen Welke 3 ontdekkingen zijn gedaan door de Voyager Space -sondes?
Welke 3 ontdekkingen zijn gedaan door de Voyager Space -sondes?  Wat is een verandering met hele atomen die worden genoemd?
Wat is een verandering met hele atomen die worden genoemd?  Waarom hebben ingenieurs chemie nodig?
Waarom hebben ingenieurs chemie nodig?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

