
Wetenschap
De meest voorkomende oxidatietoestand van elementen in groep 2a zou zijn?
Dit is waarom:
* Elektronische configuratie: Groep 2A -elementen hebben twee valentie -elektronen (elektronen in hun buitenste schaal).
* De neiging om elektronen te verliezen: Ze hebben een sterke neiging om deze twee valentie -elektronen te verliezen om een stabiele, edelgasconfiguratie te bereiken.
* Vorming van kationen: Het verliezen van twee elektronen resulteert in de vorming van een +2 kation.
Voorbeelden:
* beryllium (BE): Be
* magnesium (mg): Mg
2+
* calcium (CA): Ca
* strontium (SR): Sr
* Barium (BA): Ba
2+
* radium (ra): Ra
2+
Hoewel sommige zwaardere alkalische aardmetalen andere oxidatietoestanden kunnen vertonen onder specifieke omstandigheden, is +2 de meest voorkomende en stabiele toestand.
 Wat is covalent atoom?
Wat is covalent atoom?  Wat gebeurt er als u samen kopersulfaat en kaliumhydroxide toevoegt?
Wat gebeurt er als u samen kopersulfaat en kaliumhydroxide toevoegt?  Van welke moleculen wordt verwacht dat ze waterstofbruggen vormen in de vloeibare of vaste toestand ethyleenglycolmethanol en formaldehyde?
Van welke moleculen wordt verwacht dat ze waterstofbruggen vormen in de vloeibare of vaste toestand ethyleenglycolmethanol en formaldehyde?  Is de combinatie tussen natrium en chloor om chloride te produceren een chemische reactie?
Is de combinatie tussen natrium en chloor om chloride te produceren een chemische reactie?  Onderzoekers verklaren de verschillende geuren van baby's en tieners
Onderzoekers verklaren de verschillende geuren van baby's en tieners
 Welke satellieten of robots hebben de aarde verkend?
Welke satellieten of robots hebben de aarde verkend?  Wat zijn enkele abiotische dingen in het regenwoud?
Wat zijn enkele abiotische dingen in het regenwoud?  Onderzoeksprioriteiten identificeren voor veiligheid en veiligheidsbedreigingen in het Noordpoolgebied en de Noord-Atlantische Oceaan
Onderzoeksprioriteiten identificeren voor veiligheid en veiligheidsbedreigingen in het Noordpoolgebied en de Noord-Atlantische Oceaan Lessen over klimaatverandering van koraalriffen in de Arabische Golf
Lessen over klimaatverandering van koraalriffen in de Arabische Golf Onderzoekers ontwikkelen strategie om wijndruiven te beschermen tegen rookgeur
Onderzoekers ontwikkelen strategie om wijndruiven te beschermen tegen rookgeur
Hoofdlijnen
- Is een hypothese de verklaring voor theorie?
- Bonobo's helpen vreemden ongevraagd
- Wat eronder ligt:wortels als drijvende krachten achter het Zuid-Afrikaanse landschapspatroon
- Waarom uw dierenarts kan weigeren uw huisdier te euthanaseren
- Wat eten we? Snel identificeren van onbeschreven soorten in een commercieel schimmelpakket
- Dit is wat de wetenschap zegt over het gevoel van dieren
- Wat zijn de functies van microfilamenten en microtubuli?
- Hoe helpen bacteriën in de thee-industrie?
- De verdeling van een celkern?
- Nog een reden om van de gestreepte bas te houden:antimicrobiële middelen

- Nieuwe techniek bereidt 2-D perovskiet-eenkristallen voor voor de hoogste fotodetectie

- Duurzaamheid van nieuw creosootalternatief bevestigd
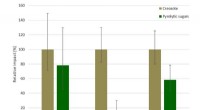
- Composteerbaar bioleer biedt duurzame oplossingen voor de kledingindustrie en daarbuiten

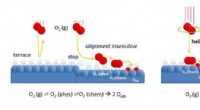
- We begrijpen eindelijk hoe zuurstof reageert op platina
 Welke intermoleculaire krachten beschrijven het beste waarom moleculen zoals CF3CF3 oplosbaar zijn in vloeibare CO2?
Welke intermoleculaire krachten beschrijven het beste waarom moleculen zoals CF3CF3 oplosbaar zijn in vloeibare CO2?  Welke twee dagen is de zon rechtstreeks op de evenaar?
Welke twee dagen is de zon rechtstreeks op de evenaar?  Verhoogde migratie aan de Amerikaanse grens in verband met klimaatverandering, geweld in Midden-Amerika
Verhoogde migratie aan de Amerikaanse grens in verband met klimaatverandering, geweld in Midden-Amerika Wat was een van de belangrijkste bezwaren tegen continentale drifthypothese?
Wat was een van de belangrijkste bezwaren tegen continentale drifthypothese?  Wat is de beste maand om Orion te zien?
Wat is de beste maand om Orion te zien?  A Als u op een trainingsfiets trapt, waar gaat de overgedragen energie naartoe?
A Als u op een trainingsfiets trapt, waar gaat de overgedragen energie naartoe?  Welk type energie zijn watergolven?
Welk type energie zijn watergolven?  Wat is het negatief geladen deeltje in een atoom?
Wat is het negatief geladen deeltje in een atoom?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

