
Wetenschap
Welke oplossingen hebben de hoogste elektrische geleidbaarheid 0,1 m NaCl BACL2 alcl3?
Inzicht in elektrische geleidbaarheid
Elektrische geleidbaarheid in oplossingen hangt af van het volgende:
* Aantal ionen: Meer ionen in oplossing betekenen meer ladingsdragers, wat leidt tot hogere geleidbaarheid.
* Laad de ionen op: Hoger geladen ionen dragen meer bij aan geleidbaarheid.
* Mobiliteit van de ionen: Ionen die gemakkelijker door de oplossing bewegen (kleinere grootte, minder interactie met watermoleculen) zullen meer bijdragen aan de geleidbaarheid.
Analyse van de oplossingen
Laten we elke oplossing afbreken:
* 0,1 m NaCl: Lost op in Na⁺ en Cl⁻ -ionen.
* 0,1 m Bacl₂: Lost op in ba²⁺ en 2 Cl⁻ -ionen (let op de hogere lading op het ba²⁺ ion).
* 0,1 m alcl₃: Lost op in Al³⁺ en 3 Cl⁻ -ionen (nogmaals, de hogere lading op het Al³⁺ -ion).
de winnaar:alcl₃
* de meeste ionen: Alcl₃ produceert de meeste ionen per mol opgeloste stof (in totaal 4 ionen).
* Hoogste lading: Al³⁺ draagt een +3 lading en draagt aanzienlijk bij aan de geleidbaarheid.
Daarom zal 0,1 M ALCL₃ de hoogste elektrische geleidbaarheid hebben.
Belangrijke opmerking: De werkelijke geleidbaarheid zal ook worden beïnvloed door factoren zoals temperatuur en de eigenschappen van het oplosmiddel. In deze vergelijking geeft ons echter een goede voorspelling op het aantal en de lading van ionen.
 Nieuwe manieren bedenken om plastic uit de oceaan te gebruiken
Nieuwe manieren bedenken om plastic uit de oceaan te gebruiken Blokkerig en rauw:maakt brutalistische architectuur een comeback?
Blokkerig en rauw:maakt brutalistische architectuur een comeback?  Hoe rustige ruimtes mensen kunnen helpen zich kalm en ontspannen te voelen in steden
Hoe rustige ruimtes mensen kunnen helpen zich kalm en ontspannen te voelen in steden 10 Voorbeelden van een natuurlijk ecosysteem
10 Voorbeelden van een natuurlijk ecosysteem Effecten van straling op plantengroei en -ontwikkeling
Effecten van straling op plantengroei en -ontwikkeling
Hoofdlijnen
- Hoe MRNA van een cel te isoleren
- Waarom hebben planten eiwitten nodig voor groei?
- Ongewervelde zeedieren hebben luidruchtige menselijke buren
- Geheugenverlies en hoofdtrauma
- Wat maken en voeren wetenschappers uit om hun hypothesen te testen?
- Wat is xeotherm?
- Wat zijn de vier stikstofbasen van DNA?
- Wat heeft een mutatie te maken met menselijk DNA?
- Hebben mensen prokaryotische of eukaryotische cellen?
- Wetenschappers onthullen belangrijke inzichten in opkomende waterzuiveringstechnologie
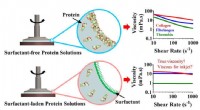
- Het vinden van vezelig eiwit kan leiden tot verbeterde bioprinting, tissue engineering
- Hoogwaardige katalysatoren op basis van grafeen
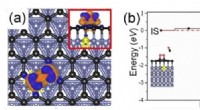
- Hoe de eerste biomoleculen gevormd konden zijn

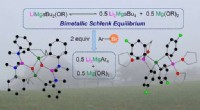
- Lithium-magnesium alkyl-alkoxy tussenproducten in Br-Mg uitwisseling
 Het ontrafelen van het wanneer, waar en hoe van vulkaanuitbarstingen
Het ontrafelen van het wanneer, waar en hoe van vulkaanuitbarstingen  AI en 5G in beeld op top mobiele beurs
AI en 5G in beeld op top mobiele beurs De snaartheorie lost het mysterie op over hoe deeltjes zich gedragen buiten een fotonensfeer met een zwart gat
De snaartheorie lost het mysterie op over hoe deeltjes zich gedragen buiten een fotonensfeer met een zwart gat  Wat is 38,49 Celsius in Fahrenheit?
Wat is 38,49 Celsius in Fahrenheit?  Terwijl Facebook wordt geconfronteerd met vuur, het wordt warm op nr. 2 Sandberg
Terwijl Facebook wordt geconfronteerd met vuur, het wordt warm op nr. 2 Sandberg Tropische cycloon 01A vormt zich in het noorden van de Indische Oceaan
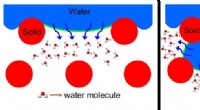
Tropische cycloon 01A vormt zich in het noorden van de Indische Oceaan Wanneer vaste stoffen en vloeistoffen elkaar ontmoeten:in detail op nanoschaal
Wanneer vaste stoffen en vloeistoffen elkaar ontmoeten:in detail op nanoschaal Nieuw papier verkent ras, vertegenwoordiging in campagnefinanciering
Nieuw papier verkent ras, vertegenwoordiging in campagnefinanciering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

