
Wetenschap
Wat gebeurt er als magnesium reageert met kopersulfaat?
* magnesium (mg) is reactiever dan koper (Cu) . Dit betekent dat magnesium een sterkere neiging heeft om elektronen te verliezen en positieve ionen te vormen.
* Wanneer magnesium wordt geplaatst in een oplossing van kopersulfaat (CUSO₄), zullen de magnesiumatomen de koperionen (Cu²⁺) van de oplossing verplaatsen.
* Magnesium zal reageren met de sulfaationen (dus₄²⁻) om magnesiumsulfaat (mgso₄) te vormen , die oplost in het water.
* De verplaatste koperionen krijgen elektronen en vormen kopermetaal (cu) , die uit de oplossing zal neerslaan als een roodbruine vaste stof.
De chemische vergelijking voor de reactie is:
Mg (s) + CUSO₄ (aq) → mgso₄ (aq) + cu (s)
Observaties:
* De blauwe kleur van de kopersulfaatoplossing zal vervagen als de koperionen worden vervangen.
* Een roodbruine vaste stof (koperen metaal) vormt zich aan de onderkant van de container.
* De reactie is exotherme, wat betekent dat het warmte vrijgeeft en de oplossing zal enigszins opwarmen.
Samenvattend:
De reactie tussen magnesium en kopersulfaat is een klassiek voorbeeld van een verplaatsingsreactie waarbij een meer reactief metaal een minder reactief metaal uit zijn oplossing verplaatst.
 NASA-NOAA-satellieten nachtzicht vinden windschering beukende tropische storm Vicky
NASA-NOAA-satellieten nachtzicht vinden windschering beukende tropische storm Vicky De planeet hacken? Geo-engineeringonderzoek, ethiek en bestuur verkend
De planeet hacken? Geo-engineeringonderzoek, ethiek en bestuur verkend  Pet-tags koppelen veelgebruikte vlamvertragers aan hyperthyreoïdie bij katten
Pet-tags koppelen veelgebruikte vlamvertragers aan hyperthyreoïdie bij katten Wat wordt bedoeld met zonen van de bodem in context voor human resources?
Wat wordt bedoeld met zonen van de bodem in context voor human resources?  Overstromingen Myanmar dwingen tienduizenden huizen uit
Overstromingen Myanmar dwingen tienduizenden huizen uit
Hoofdlijnen
- Wie erkende voor het eerst dat soorten groepen organismen waren die zich onderscheidden door hun vermogen om zich te voortplanten?
- Waarom verspreidt voedselkleuring zich in water?
- Is eiwitexpressie en zuivering een wetenschappelijk proces?
- Discovery onthult hoe planten cellulose maken voor kracht en groei
- Onderzoekers ontwikkelen algoritmen om te begrijpen hoe mensen de woordenschat van lichaamsdelen vormen
- Wat zijn voordelen van eiwitten?
- Wat zijn kenmerken van de domein archaea en diverse informatie over dit domein?
- Wat is de functie van spicula?
- Onderzoek details genetische resistentie tegen plotselinge dood syndroom in sojabonen
- Zeewier, slijm en sokken:de wetenschap achter het zeepsop

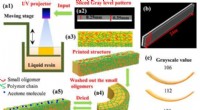
- 4D-printen van omkeerbare vormveranderende materialen met op licht gebaseerde grijswaardenpatronen
- Polymere membranen gebruiken om industriële scheidingen op te ruimen

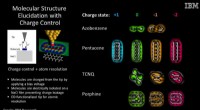
- Onderzoekers brengen moleculen in beeld terwijl ze voor het eerst van lading veranderen
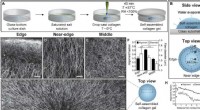
- Marangoni-stromen stimuleren de uitlijning van met fibrillaire cellen beladen hydrogels
 Hebben eiwitten zowel structurele als regulerende functies in het lichaam?
Hebben eiwitten zowel structurele als regulerende functies in het lichaam?  Wat zijn voorbeelden van betoverende dingen?
Wat zijn voorbeelden van betoverende dingen?  PizzaGAN krijgt de foto over hoe je een pizza maakt
PizzaGAN krijgt de foto over hoe je een pizza maakt Test een geoloog water in Antarctica?
Test een geoloog water in Antarctica?  Zijn pesticiden die in stedelijke en voorstedelijke gebieden worden gebruikt schadelijk voor de honingbijen?
Zijn pesticiden die in stedelijke en voorstedelijke gebieden worden gebruikt schadelijk voor de honingbijen?  Doos chocolaatjes? Waarom het leven eigenlijk lijkt op een March Madness Bracket
Doos chocolaatjes? Waarom het leven eigenlijk lijkt op een March Madness Bracket  Het in kaart brengen van de toekomstige goede plek voor schone energie en biodiversiteit
Het in kaart brengen van de toekomstige goede plek voor schone energie en biodiversiteit  De grootste uitdaging van de nieuwe Tesla-voorzitters is het beheersen van Musk
De grootste uitdaging van de nieuwe Tesla-voorzitters is het beheersen van Musk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

