
Wetenschap
Hoe moleculaire riboswitches werken in bacteriën
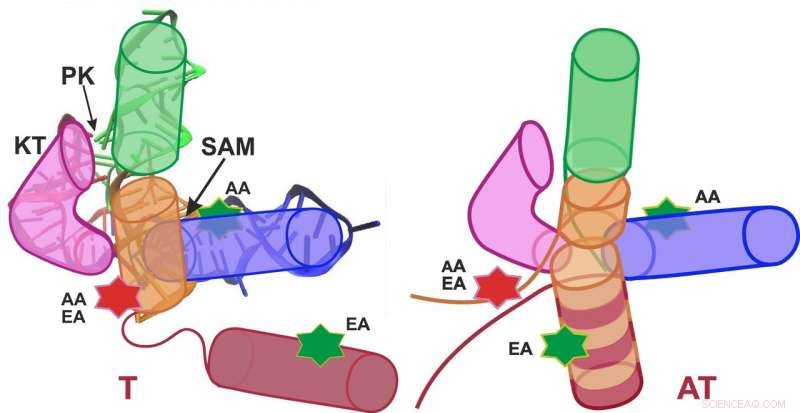
Schematische weergave van de SAM-I riboswitch in de terminator conformatie (uitschakelen; links) en anti-terminator conformatie (inschakelen; rechts). Credit:Grafisch:APH/KIT
Veel bacteriën hebben moleculaire controle-elementen waarmee ze genen aan en uit kunnen zetten. Deze riboswitches openen ook nieuwe mogelijkheden bij de ontwikkeling van antibiotica of de detectie en afbraak van milieutoxines. Onderzoekers van het Karlsruhe Institute of Technology (KIT), Universiteit van Heidelberg, en Freie Universität Berlin hebben nu licht optische microscopie van afzonderlijke moleculen gebruikt om de manier waarop riboswitches werken fundamenteel te bestuderen. Dit wordt gemeld in Natuur Chemische Biologie .
Riboswitches bevinden zich op het boodschapper-ribonucleïnezuur (mRNA) dat genetische informatie naar de plaats van eiwitbiosynthese transporteert. Een riboswitch bestaat uit een sensor die de concentratie van een klein metabolisch molecuul meet en een effector die de genexpressie controleert en, Vandaar, synthese van een eiwit. Omdat riboswitches in veel bacteriële pathogenen voorkomen, ze vertegenwoordigen belangrijke doelen bij de ontwikkeling van nieuwe antibiotica. Andere toepassingen zijn mogelijk in de synthetische biologie. Bijvoorbeeld, bacteriën kunnen genetisch worden gemodificeerd met riboswitches om laagmoleculaire milieutoxines te detecteren en af te breken, zoals herbiciden. Echter, fundamenteel begrip van de processen die ten grondslag liggen aan de functie van riboswitches is vereist. Het werk gepresenteerd in Natuur Chemische Biologie is hierin een essentiële bijdrage.
De onderzoeksgroepen van professor Gerd Ulrich Nienhaus van het KIT en professor Andres Jäschke van de Universiteit van Heidelberg bestudeerden de S-adenosyl-L-methionine (SAM)-I riboswitch. "Bevestiging van het SAM-molecuul aan deze riboswitch veroorzaakt de conformatie, dat is de ruimtelijke ordening van atomen, om te veranderen van de anti-terminator (AT) naar de terminator (T) structuur, Nienhaus legt uit. "Hierdoor genexpressie is uitgeschakeld."
Eerst, de wetenschappers in Heidelberg synthetiseerden SAM-I riboswitches en markeerden ze specifiek met twee fluorescerende kleurstoffen, elk op verschillende punten. De onderzoekers van KIT bestudeerden deze RNA-moleculen vervolgens met een hoge ruimtelijke en temporele resolutie met behulp van zeer gevoelige lichtmicroscopen die de fluorescentie-emissie van enkelvoudige kleurstofmoleculen meten. Door middel van Förster-resonantie-energieoverdracht (FRET) experimenten, conformatiedynamiek werd direct bepaald. Voor dit doeleinde, laserstraling wordt gebruikt om een groene kleurstof licht te laten uitstralen. Als zich een rode kleurstof in de buurt bevindt, het kan de excitatie-energie van de groene kleurstof overnemen en zelf licht uitstralen.
De kans op energieoverdracht is sterk afhankelijk van de afstand van de kleurstoffen tot elkaar. Structurele veranderingen van een molecuul waaraan de kleurstoffen specifiek zijn gehecht, kunnen direct worden waargenomen via emissie van de rode kleurstof. Lichtemissie is extreem zwak, die complexe data-analysemethoden vereisen op basis van verborgen Markov-modellering. Professor Bettina Keller van het Instituut voor Chemie en Biochemie van de Freie Universität Berlin ontwikkelde de methoden speciaal voor dit soort experimenten om tijdsafhankelijke lichtemissiesignalen te onderscheiden van ruis.
In hun analyse de onderzoekers onderscheidden twee conformaties (T en AT) van de SAM-I riboswitch, en in totaal vier conformaties (T1, T2, BIJ 1, en AT2). Verrassend genoeg, de riboswitch schakelde niet volledig tussen de T- en AT-structuren in aanwezigheid en afwezigheid van SAM, zoals verwacht, maar fluctueerde permanent tussen alle staten - alleen wegingen werden verschoven. Een belangrijk resultaat voor de biologische functie was dat structuurfluctuaties die werden waargenomen met een aangehechte SAM veel sneller waren dan zonder SAM. Omdat de riboswitch-sequentie op het boodschapper-RNA zich direct voor het te controleren gen bevindt, het RNA-molecuul moet zo snel mogelijk na synthese in aanwezigheid van SAM een T-structuur vormen (uitschakelen) om latere transcriptie van het te controleren gen te voorkomen. Versnelling van structuurfluctuaties door SAM-bevestiging zorgt dus voor voldoende snelle vorming van een T-structuur. "Bijgevolg, dynamiek van de SAM-I riboswitch een belangrijke rol spelen voor zijn functie, Nienhaus zegt. "Deze gedetailleerde inzichten in het functioneren van een biomolecuul zijn het resultaat van een interdisciplinaire benadering van de natuurkunde, biotechnologie, en theoretische chemie."
 Dalian Coherent Light Source onthult de oorsprong van interstellaire disulfur
Dalian Coherent Light Source onthult de oorsprong van interstellaire disulfur Zeer selectief adsorberend materiaal trekt ongewenste stoffen aan om bioproductie ten goede te komen
Zeer selectief adsorberend materiaal trekt ongewenste stoffen aan om bioproductie ten goede te komen Flexibiliteit en rangschikking - de interactie van ribonucleïnezuur en water
Flexibiliteit en rangschikking - de interactie van ribonucleïnezuur en water Volledig hydrofobe ionogel ontwikkeld voor draagbare onderwatersensor en communicator
Volledig hydrofobe ionogel ontwikkeld voor draagbare onderwatersensor en communicator Verschil tussen zwavel en zwavel
Verschil tussen zwavel en zwavel
 Studie van Amerikaanse tonijnvisserij onderzoekt verband tussen klimaatverandering, duurzame zeevruchten
Studie van Amerikaanse tonijnvisserij onderzoekt verband tussen klimaatverandering, duurzame zeevruchten Tribale aanvraag voor Dakota Access lekresponsplan toegekend
Tribale aanvraag voor Dakota Access lekresponsplan toegekend Paddenstoelenleer kan de sleutel zijn tot duurzame mode
Paddenstoelenleer kan de sleutel zijn tot duurzame mode Plan om de Hudson River te herstellen en te beschermen
Plan om de Hudson River te herstellen en te beschermen Afval van de top van de wereld ingeleverd voor recycling in Nepal
Afval van de top van de wereld ingeleverd voor recycling in Nepal
Hoofdlijnen
- Hoe te lezen Proteïne elektroforese
- Wat zijn de belangrijkste functies van Cilia & Flagella?
- Bloemen geheim signaal voor bijen en andere verbazingwekkende nanotechnologieën verborgen in planten
- Maken planten muziek?
- Hoe kan een mutatie in DNA de eiwitsynthese beïnvloeden?
- Nucleic Acid Facts
- Wormgenomen onthullen een verband tussen mensen en verre verwanten
- Hoe werkt het spierstelsel met de bloedsomloop?
- Hoe het Human Microbiome-project werkt
- Van de weegschaal:Vispantser zowel sterk als flexibel

- Supercontinuum-lasers kunnen leiden tot beter brood en bier

- Door licht geïnduceerde modificatie van een carbonzuur met een aminocyclopropenon
- Is zweten endotherm of exotherm?

- Verschillen in vetweefsel lichtreflecterende eigenschappen zorgen voor gemakkelijke detectie

 How Do Alligators Mate?
How Do Alligators Mate?  Griekenland hoopt de komende uren bosbranden onder controle te krijgen
Griekenland hoopt de komende uren bosbranden onder controle te krijgen Tekort aan klimaatactie is catastrofaal:UN
Tekort aan klimaatactie is catastrofaal:UN Hoe wiskundige hulpmiddelen met vermenigvuldiging te maken met behulp van ijslollystokjes
Hoe wiskundige hulpmiddelen met vermenigvuldiging te maken met behulp van ijslollystokjes  Hoe de K-waarde op een titratiegrafiek te berekenen
Hoe de K-waarde op een titratiegrafiek te berekenen  Suikers in moedermelk zijn een nieuwe klasse van antibacteriële middelen
Suikers in moedermelk zijn een nieuwe klasse van antibacteriële middelen Chemie maakt de weg vrij voor verbeterde elektronische materialen
Chemie maakt de weg vrij voor verbeterde elektronische materialen Fungus Vs. Mold
Fungus Vs. Mold
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

