
Wetenschap
Hoe onderscheid je je tussen zwaveldioxide en trioxide?
1. Chemische formule:
* zwaveldioxide (So₂): Bevat één zwavelatoom en twee zuurstofatomen.
* zwaveltrioxide (So₃): Bevat één zwavelatoom en drie zuurstofatomen.
2. Fysieke toestand bij kamertemperatuur:
* zwaveldioxide (So₂): Een kleurloos gas met een scherpe, verstikkende geur.
* zwaveltrioxide (So₃): Bestaat als een kleurloze vloeistof of een witte vaste stof.
3. Reactiviteit:
* zwaveldioxide (So₂): Een reactief gas dat oplost in water om zwavelzuur te vormen (h₂so₃), een zwak zuur. Het fungeert als een reductiemiddel.
* zwaveltrioxide (So₃): Een zeer reactief gas dat oplost in water om zwavelzuur te vormen (h₂so₄), een sterk zuur. Het fungeert als een oxidatiemiddel.
4. Gebruik:
* zwaveldioxide (So₂): Gebruikt bij de productie van zwavelzuur, als een conserveermiddel in voedsel en wijn, en als een bleekmiddel.
* zwaveltrioxide (So₃): Voornamelijk gebruikt bij de productie van zwavelzuur.
5. Milieu -impact:
* zwaveldioxide (So₂): Een grote luchtverontreinigende stof die bijdraagt aan zure regen en ademhalingsproblemen.
* zwaveltrioxide (So₃): Draagt ook bij aan zure regen, maar de belangrijkste impact is gerelateerd aan de productie van zwavelzuur.
Samenvattend:
De belangrijkste verschillen liggen in hun chemische samenstelling, fysieke toestand, reactiviteit, gebruik en milieu -impact. Hoewel beide zwaveloxiden zijn, is zwaveltrioxide een sterker zuur- en oxidatiemiddel, wat leidt tot het primaire gebruik ervan bij de productie van zwavelzuur. Zwaveldioxide is daarentegen een meer veelzijdige verbinding met verschillende toepassingen en een aanzienlijke milieu -impact.
 Oceanen zijn een voorbeeld van welke oplossing?
Oceanen zijn een voorbeeld van welke oplossing?  Elektronenstraal versterkt recyclebaar nanocomposiet
Elektronenstraal versterkt recyclebaar nanocomposiet Gemodificeerd enzym kan de productie van ethanol van de tweede generatie verhogen
Gemodificeerd enzym kan de productie van ethanol van de tweede generatie verhogen Wat zijn polymeren die tot 20 verschillende soorten bevatten?
Wat zijn polymeren die tot 20 verschillende soorten bevatten?  Op welke twee manieren kunnen alle bronnen van verontreinigende stoffen worden geclassificeerd?
Op welke twee manieren kunnen alle bronnen van verontreinigende stoffen worden geclassificeerd?
 Dag van de Aarde 2024:Vier effectieve strategieën om voedselverspilling door huishoudens te verminderen
Dag van de Aarde 2024:Vier effectieve strategieën om voedselverspilling door huishoudens te verminderen  Meer dan een eeuw aan Arctisch zee-ijsvolume gereconstrueerd met behulp van historische scheepslogboeken
Meer dan een eeuw aan Arctisch zee-ijsvolume gereconstrueerd met behulp van historische scheepslogboeken Een klimaatschurk? Het meten en beheren van de impact van vlees op de planeet
Een klimaatschurk? Het meten en beheren van de impact van vlees op de planeet  Koolstofbelastingen kunnen zowel eerlijk als effectief zijn, studie toont
Koolstofbelastingen kunnen zowel eerlijk als effectief zijn, studie toont Is de toekomst van orkaanvoorspellingen in gevaar?
Is de toekomst van orkaanvoorspellingen in gevaar?
Hoofdlijnen
- Hoe planten microben benutten om voedingsstoffen binnen te krijgen
- Welk aspect van de celfunctie omvat het verplaatsen van stoffen en signalen tussen organellen?
- Waarom leven vrouwen langer dan mannen?
- Wat gebeurt er tijdens meiose anafase 1?
- Wat zijn de drie enzymen geproduceerd in de twaalfvingerige darm?
- Hoe produceert het zenuwstelsel een reactie?
- Contractiele eiwitten zijn in wat te vinden?
- Is er een gen voor vastberadenheid?
- De ontdekking van een atypische hitteschokfactor, HSF5, die betrokken is bij meiotische mechanismen, heeft implicaties voor mannelijke onvruchtbaarheid
- Onderzoekers ontdekken een manier om de kleur van OLED's te controleren
- Onderzoeksteam zet het vuur op 3D-printinkten

- Onderzoeksteam ontwikkelt materiaal om olie en water te scheiden voor milieusanering en afvalwaterzuivering

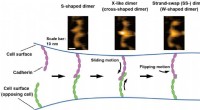
- Visualisatie van bindingsprocessen van cel-celadhesiemoleculen in oplossing
- Coumarineverbindingen uit eikenhouten vaten kunnen bijdragen aan de bittere smaak van wijn en sterke drank

 Onderzoek toont aan waarom meteroïden ontploffen voordat ze de aarde bereiken
Onderzoek toont aan waarom meteroïden ontploffen voordat ze de aarde bereiken  Wat is Ceres afstand van de zon AU?
Wat is Ceres afstand van de zon AU?  SpaceX Starship landt rechtop, explodeert dan in de laatste test
SpaceX Starship landt rechtop, explodeert dan in de laatste test Overwerkt en geïsoleerd:de stijgende epidemie van eenzaamheid in de academische wereld
Overwerkt en geïsoleerd:de stijgende epidemie van eenzaamheid in de academische wereld Een golf waarin het medium loodrecht trilt voor de beweging van wordt een golf genoemd?
Een golf waarin het medium loodrecht trilt voor de beweging van wordt een golf genoemd?  Hoeveel mol in 55 g lithiumchloride?
Hoeveel mol in 55 g lithiumchloride?  Hybride benadering voorspelt en bevestigt de structuur van complexe metalen nanodeeltjes
Hybride benadering voorspelt en bevestigt de structuur van complexe metalen nanodeeltjes Eerste structuur van volledige lengte van GLP-1-receptor gebonden aan peptide-agonist
Eerste structuur van volledige lengte van GLP-1-receptor gebonden aan peptide-agonist
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

