
Wetenschap
Visualisatie van bindingsprocessen van cel-celadhesiemoleculen in oplossing
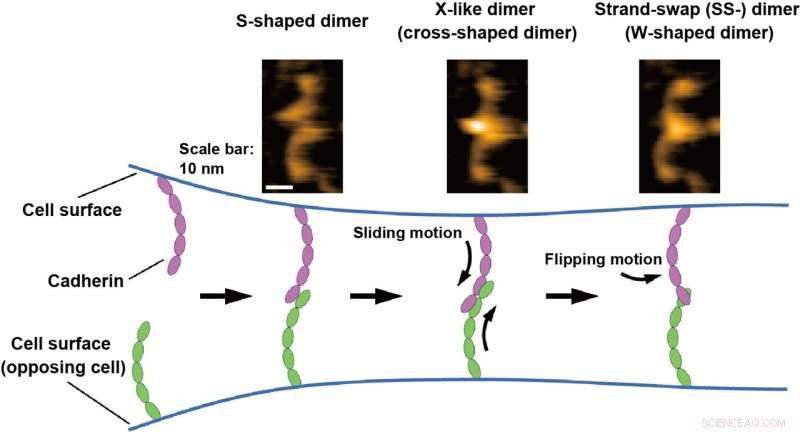
HS-AFM-afbeeldingen van de cadherine-dimeren worden bovenaan weergegeven. Het bindingsmechanisme van cadherines wordt onderaan geïllustreerd op basis van HS-AFM-waarnemingen. Credit:Shigetaka Nishiguchi van wetenschappers van het Exploratory Research Center on Life and Living Systems (ExCELLS)
Cel-, weefsel- en orgaanstructuur wordt in stand gehouden door cel-celadhesiemoleculen die tegengestelde cellen verbinden. Cadherines zijn een klasse van essentiële cel-celadhesiemoleculen voor weefselvorming en integriteit, en defecten in de cadherinefunctie veroorzaken verschillende ziekten (bijvoorbeeld kankerinvasie). Cadherine steekt uit het celoppervlak en bindt een andere cadherine op een tegenoverliggende cel om cel-celadhesie te mediëren. Het cadherinebindingsproces omvat hoofdzakelijk twee dimerisatiestappen:X-dimeervorming en streng-swap (SS-) dimeervorming van de extracellulaire domeinen (ectodomeinen) van cadherine. Er zijn echter ook andere interacties voorgesteld dan die waarbij de vorming van de X- en SS-dimeren betrokken is, en het precieze bindingsmechanisme van cadherine blijft controversieel.
Shigetaka Nishiguchi van ExCELLS, Takayuki Uchihashi van ExCELLS en Nagoya University, en Tadaomi Furuta van Tokyo Tech pasten snelle atoomkrachtmicroscopie (HS-AFM) toe om het bindingsmechanisme van cadherines te onderzoeken. HS-AFM kan de visualisatie van structuren en dynamiek van één molecuul in oplossing op nanometerschaal met een tijdsresolutie van minder dan een seconde mogelijk maken door het oppervlak van eiwitten rechtstreeks aan te raken en te scannen via een sonde met een scherpe punt. HS-AFM onthulde dat cadherines bestonden als meerdere dimere structuren, die op basis van hun morfologie kunnen worden geclassificeerd als W-, kruis- en S-vormige dimeren.
Verder voerden de wetenschappers mutatie- en structurele modelleringsanalyses uit en ontdekten dat W- en kruisvormige dimeren overeenkwamen met bekende SS-dimeren en X-achtige dimeren en dat het S-vormige dimeer een nieuwe conformatie is. De bindingsprocessen van cadherines die direct door HS-AFM werden gevisualiseerd, onthulden ook dat het dimerisatieproces binnen één seconde wordt voltooid door omzetting in de bovengenoemde drie soorten dimere structuren. Op basis van deze HS-AFM-waarnemingen veronderstelden de wetenschappers dat het bindingsmechanisme voortschrijdt door de glijdende beweging van het S-vormige dimeer, gevolgd door de draaiende beweging van het X-dimeer om het SS-dimeer te vormen, waarvan wordt aangenomen dat het de laatste is. stabiel cadherine-dimeer.
Tot op heden is het bindingsmechanisme van cadherines voornamelijk onderzocht met behulp van structurele analyses en cel- en oplossingsmetingen, die alleen de bindingstoestanden kunnen analyseren die worden weerspiegeld door het grote aantal cadherines. De nieuw toegepaste HS-AFM-techniek onthulde de bindingsprocessen van individuele cadherines bij een resolutie van één molecuul, wat nog niet eerder is bereikt. HS-AFM-observatie zal de weg vrijmaken voor een dieper begrip van het bindingsmechanisme van cadherines, wat belangrijk is voor de organisatie op weefsel- en orgaanniveau en voor aan cel-celadhesie gerelateerde ziekten.
Het onderzoek is gepubliceerd in Proceedings of the National Academy of Sciences . + Verder verkennen
Bevindingen onthullen nieuw activeringsmechanisme voor ALK
 Niet-toxische onderwaterlijm kan nieuwe chirurgische lijm opleveren
Niet-toxische onderwaterlijm kan nieuwe chirurgische lijm opleveren Onderzoekers visualiseren de motor van bacteriën in de eerste stap naar door mensen geproduceerde elektrische energie
Onderzoekers visualiseren de motor van bacteriën in de eerste stap naar door mensen geproduceerde elektrische energie Type energie geproduceerd door fotosynthese
Type energie geproduceerd door fotosynthese Nieuwe tool kan onderzoekers helpen enzymen in microbiomen te identificeren
Nieuwe tool kan onderzoekers helpen enzymen in microbiomen te identificeren Virulentiefactor van het influenza A-virus in realtime in kaart gebracht
Virulentiefactor van het influenza A-virus in realtime in kaart gebracht
Hoofdlijnen
- Aleppo-momenten:wat zorgt ervoor dat onze hersenen onder druk bevriezen?
- Vogels onthullen het belang van goede buren voor gezondheid en veroudering
- Welke sequenties zorgen ervoor dat DNA uitpakt en ademt?
- Kamgelei mogelijk eerste afstamming van evolutionaire boom
- Onderzoek naar parasieten effent de weg voor infectietherapieën
- Studie kan bijdragen aan toolbox voor resourcemanagers
- Nobel werpt licht op paleogenetica, studie van oud DNA
- Hoe HeLa-cellen werken
- Wetenschappers ontdekken boodschapper-RNA met twee functies
- Wat is de optimale pH voor menselijke maag-enzymactiviteit?

- Water helpt bij de onverwachte en ultrasnelle synthese van collageenachtig synthetisch poly-L-proline

- Zeer uniforme en lage hysterese druksensor om de praktische toepasbaarheid te vergroten

- Transplantatiebeschadigend virus komt in beeld
- Hoe plastic-etende bacteriën eigenlijk werken - legt een chemicus uit
 Hoe werkt een nepuil om vogels weg te jagen?
Hoe werkt een nepuil om vogels weg te jagen?  Istanbul:zeebodemstudie bewijst voor het eerst het risico op aardbevingen
Istanbul:zeebodemstudie bewijst voor het eerst het risico op aardbevingen De dreiging van asteroïden en kometen volgen
De dreiging van asteroïden en kometen volgen Hoe ernstige droogte ozonvervuiling beïnvloedt
Hoe ernstige droogte ozonvervuiling beïnvloedt Nieuwe lensloze camera maakt gedetailleerde 3D-beelden zonder te scannen
Nieuwe lensloze camera maakt gedetailleerde 3D-beelden zonder te scannen Nieuw onderzoek vindt raciale vooroordelen in rideshare-platforms
Nieuw onderzoek vindt raciale vooroordelen in rideshare-platforms Voorstellen zouden Little Colorado River afdammen voor waterkracht
Voorstellen zouden Little Colorado River afdammen voor waterkracht Een heel groot probleem:de stijgende zeespiegel zal het komende decennium tot aanzienlijke verplaatsingen leiden
Een heel groot probleem:de stijgende zeespiegel zal het komende decennium tot aanzienlijke verplaatsingen leiden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

