
Wetenschap
Nieuwe familie in de buurt:een nieuwe groep glycosidische enzymen

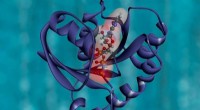
Het enzym SGL, een lid van de GH-familie, is betrokken bij het metabolisme van β-1, 2-glucaan, een extracellulair koolhydraat dat een belangrijke rol speelt in de symbiose. Krediet:Tokyo University of Science
Een groep onderzoekers uit Japan heeft een nieuw enzym ontdekt uit een bodemschimmel. In hun studie gepubliceerd in de Tijdschrift voor biologische chemie , ze speculeren dat dit enzym een belangrijke rol speelt in het bodemecosysteem, en beschrijf vervolgens de structuur en werking ervan. Zodra het nut van het hoofdproduct van dit enzym in de toekomst beter wordt begrepen, dit enzym zou ook voor industriële doeleinden kunnen worden benut. De onderzoekers stellen, "Onze studie werpt licht op het feit dat er nog steeds nieuwe enzymen worden ontdekt. Het legt mogelijk de basis voor verder onderzoek om nieuwe enzymen te identificeren die koolhydraten opleveren waarvan ooit werd gedacht dat ze extreem moeilijk te bereiden waren."
Koolhydraten zijn waarschijnlijk de meest veelzijdige organische moleculen op aarde, omdat ze verschillende rollen spelen in organismen. Overeenkomstig, de functies en structuren van enzymen die verband houden met koolhydraten zijn net zo divers. Glycosidehydrolasen (GH's) zijn enzymen die "glycosidebindingen" in koolhydraten of suikers verbreken. GH's zijn de grootste bekende groep van koolhydraatgerelateerde enzymen, en de groep wordt steeds groter. Een roman familie, GH144, werd in het verleden door dezelfde onderzoeksgroep geïdentificeerd uit een bodembacterie Chitinophaga pinensis en werd CpSGL genoemd.
Het enzym endo-β-1, 2-glucanase (SGL), een lid van de GH-familie, is betrokken bij het metabolisme van β-1, 2-glucaan, dat is een polysacharide (suikerketen) samengesteld uit β-1, 2-gekoppelde glucose-eenheden. -1, 2-glucaan dient als een extracellulair koolhydraat dat een belangrijke rol speelt in de symbiose of besmettelijkheid van sommige bacteriën. Echter, de rol van SGL's in eukaryote cellen en hun relatie met bacteriële SGL's zijn niet goed begrepen.
Deze groep Japanse wetenschappers van verschillende universiteiten en een onderzoeksinstituut, werken aan een samenwerkingsproject geleid door Masahiro Nakajima, heeft een nieuw SGL-enzym ontdekt uit een bodemschimmel, Talaromyces funiculosus. Het enzym, hierna TfSGL genoemd, vertoonde geen significante sequentieovereenkomst met andere bekende GH-families. Echter, het vertoonde significante overeenkomsten met andere eukaryote eiwitten met onbekende functies. De onderzoekers stellen dus voor dat TfSGL en deze verwante GH-enzymen worden ingedeeld in een nieuwe familie, die ze GH162 noemen.
Meestal wanneer wetenschappers een nieuw eiwit vinden - in dit geval een enzym - ze klonen verder het gen dat de sequentie bevat die ervoor codeert om de functionaliteit ervan beter te begrijpen. Deze kloon wordt een "recombinante" sequentie genoemd. Het recombinante TfSGL-eiwit (TfSGLr) bleek zowel lineaire als cyclische β-1 af te breken, 2-glucanen tot sophorose, een eenvoudiger en kleiner koolhydraat.
Stereochemische analyse uitgevoerd door deze onderzoekers onthulde dat het een inverterend enzym is, een kenmerk dat verband houdt met het werkingsmechanisme. Ze ontdekten dat TfSGL sophoro-oligosachariden (β-1, 2-glucooligosacchariden), met een polymerisatiegraad van 5 of meer, aan de disaccharide sophorose als het hoofdproduct.
Röntgenkristalstructuuranalyse onthulde dat de algehele structuur van TfSGLr vergelijkbaar is met die van leden van de eerder genoemde GH144-familie, met name CpSGL. Echter, de twee enzymen zijn zeer verschillend in aminozuursequenties, evenals substraatherkenningsplaatsen en de posities van de basiskatalysator. Dit verschil geeft aan dat TfSGL en zijn homologen waarschijnlijk een nieuwe familie vormen, en dat er een moleculair evolutionaire relatie zou kunnen zijn tussen GH144 en GH162.
In feite, de meeste TfSGL-homologen worden gevonden in eukaryote organismen, met name schimmels (Basidiomycota en Ascomycota), en slijmzwammen (Mycetozoa). Sommige van deze soorten worden geassocieerd met de rhizosfeer, dat is het ecosysteem rond de wortel en de bodem, waar het metabolisme van cyclische β-1, 2-glucan kan voorkomen als onderdeel van deze symbiotische relatie met planten. Andere soorten zijn parasitair, en daarom, er wordt aangenomen dat de cyclische β-1, 2-glucan kan worden gebruikt om de immuunresponsen bij gastheren te verminderen. Er wordt ook gespeculeerd dat TfSGL-homologen betrokken zijn bij interacties met andere organismen.
Dit nieuwe enzym, TfSGL, breekt β-1 af, 2-glucan in sophorose. Volgens Nakajima, "Naarmate de functies en toepassingen van sophorose in de toekomst duidelijker worden, het enzym zou mogelijk kunnen worden gebruikt voor de productie van sophorose. β-Glucanasen spelen al een belangrijke rol in ons leven, omdat ze veel worden gebruikt bij de productie van biobrandstoffen.
Nakajima besluit met de veronderstelling, "De structuren van suikerketens zijn complex en divers, en suikerketens zijn ook betrokken bij verschillende levensverschijnselen. Synthese en afbraak van dergelijke diverse suikerketenstructuren worden uitgevoerd door enzymen, maar slechts één uiteinde van de diversiteit lijkt te zijn begrepen. Met ons onderzoek, we hopen genen te identificeren die coderen voor nieuwe enzymen die suikerketens afbreken en koolhydraten opleveren die ooit als extreem moeilijk te bereiden werden beschouwd."
 Wat is de chemische MDI?
Wat is de chemische MDI?  Oligourea-foldamers bootsen peptiden alfa-helices na en binden effectief aan medicijndoelen
Oligourea-foldamers bootsen peptiden alfa-helices na en binden effectief aan medicijndoelen Big data en synthetische chemie kunnen klimaatverandering en vervuiling tegengaan
Big data en synthetische chemie kunnen klimaatverandering en vervuiling tegengaan Antiblokkeersysteem in slagaders beschermt tegen hartaanvallen
Antiblokkeersysteem in slagaders beschermt tegen hartaanvallen De vorm van de dingen die komen gaan:flexibel, opvouwbare supercondensatoren voor energieopslag
De vorm van de dingen die komen gaan:flexibel, opvouwbare supercondensatoren voor energieopslag
Hoofdlijnen
- Menselijke evolutie: tijdlijn, stadia, theorieën en bewijsmateriaal
- Wetenschap komt dichter bij het verklaren van de boze dronkaard
- Supermensen creëren door middel van genmanipulatie en meer
- Californische condors keren terug naar de lucht na bijna uitsterven
- Inspanningen om zeeschildpadden te redden zijn een wereldwijd succesverhaal op het gebied van natuurbehoud:wetenschappers
- Bacteriën als pacemaker voor de darm
- Hoe wetenschappers ons hebben gered van de ineenstorting van de sint-jakobsschelp
- Bevindingen sonde cel samenwerking, massale migratie
- Studie onderzoekt de impact van leeuwen die naast giraffenpopulaties leven
- Wat zijn de effecten van koken en bevriezen op de enzymactiviteit?

- Regeling van bellenvorming op elektroden
- Wetenschappers maximaliseren de effectiviteit van platina in brandstofcellen

- Hoe het percentage van een isotoop te berekenen

- Nieuwe structurele eenheid vereenvoudigt het proces van het op maat ontwerpen van eiwitten
 Het begin van een revolutie in verpakkingen
Het begin van een revolutie in verpakkingen Opwarmende rivieren leveren een duidelijke bijdrage aan de wereldwijde broeikasgasniveaus
Opwarmende rivieren leveren een duidelijke bijdrage aan de wereldwijde broeikasgasniveaus Quantum dots kunnen kloonachtige fotonen uitspugen
Quantum dots kunnen kloonachtige fotonen uitspugen Nieuwe kijk op hoe oceaanpompen de klimaatverandering beïnvloeden
Nieuwe kijk op hoe oceaanpompen de klimaatverandering beïnvloeden Watersplitsing stimuleren om chemische brandstoffen te maken
Watersplitsing stimuleren om chemische brandstoffen te maken Onderzoekers leggen bewegende objecten vast met ghost imaging
Onderzoekers leggen bewegende objecten vast met ghost imaging Onderzoek onthult robuuste prestaties in verouderde detonatorexplosief
Onderzoek onthult robuuste prestaties in verouderde detonatorexplosief Hoe ideeën viraal gaan in de academische wereld
Hoe ideeën viraal gaan in de academische wereld
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

