
Wetenschap
Hoe worden de buitenste schelpen van twee atomen die covalent zijn gebonden?
Covalente Bonding Basics
* Elektronen delen: Bij covalente binding delen atomen elektronen om een stabiele elektronenconfiguratie te bereiken, meestal op een edelgas.
* buitenste schaal: Dit delen gebeurt voornamelijk in de buitenste elektronenschil, ook bekend als de valentieschaal.
* stabiliteit: Door elektronen te delen, voltooien atomen hun valentieschalen, waardoor stabiliteit wordt gekregen.
Het proces
1. overlappen: Wanneer twee atomen elkaar naderen, beginnen hun valentieschalen elkaar te overlappen.
2. delen: Elektronen in de overlappende regio's worden nu gedeeld tussen de twee atomen. Dit gedeeld paar elektronen wordt een "bindingspaar" genoemd.
3. Stabiele configuratie: Elk atoom heeft nu effectief een volledige valentie -schaal, wat bijdraagt aan de stabiliteit van het molecuul.
Voorbeeld:water (h₂o)
* zuurstof (O): Heeft 6 valentie -elektronen (2S² 2P⁴). Het heeft nog 2 elektronen nodig om een volledige buitenste schaal te hebben (zoals neon).
* waterstof (h): Heeft 1 valentie -elektron (1S¹). Het heeft nog 1 elektron nodig om een volledige buitenste schaal te hebben (zoals helium).
* Vorming van water: Het zuurstofatoom deelt een van zijn elektronen met elk waterstofatoom. Elk waterstofatoom deelt zijn elektron met het zuurstofatoom. Dit resulteert in twee gedeelde paren elektronen, die twee covalente bindingen vormen en elk atoom een stabiele configuratie geven.
Key Points
* Soorten covalente bindingen:
* Enkele covalente binding: Een gedeeld paar elektronen (bijv. H₂o)
* Dubbele covalente binding: Twee gedeelde paren elektronen (bijv. O₂).
* Drievoudige covalente binding: Drie gedeelde paren elektronen (bijv. N₂).
* Polaire covalente bindingen: In sommige gevallen worden elektronen niet gelijk gedeeld. Het atoom met een sterkere trek op de elektronen wordt enigszins negatief en het andere atoom wordt enigszins positief. Dit creëert een polair molecuul, zoals water (h₂o).
In wezen omvat covalente binding het delen van elektronen in de buitenste schalen van atomen, wat leidt tot een stabiele configuratie voor beide betrokken atomen.
 Externe structuur kan de functie van enzymen beïnvloeden
Externe structuur kan de functie van enzymen beïnvloeden Wat is niet -cyclische koeling?
Wat is niet -cyclische koeling?  Wat is er met de verschillende deeltjes gebeurd als kristallen oploven in waterdeteltjes?
Wat is er met de verschillende deeltjes gebeurd als kristallen oploven in waterdeteltjes?  De deeltjes van een suspensie worden opgelost in het oplosmiddel.?
De deeltjes van een suspensie worden opgelost in het oplosmiddel.?  Hoe kan Krypton reageren om een adellijke gasconfiguratie te bereiken?
Hoe kan Krypton reageren om een adellijke gasconfiguratie te bereiken?
 NASA kijkt naar de ontwikkeling van tropische storm Ophelia
NASA kijkt naar de ontwikkeling van tropische storm Ophelia Onderzoek toont een versnelling van de wereldgemiddelde oceaancirculatie sinds de jaren negentig aan
Onderzoek toont een versnelling van de wereldgemiddelde oceaancirculatie sinds de jaren negentig aan Wat is allemaal vocht dat terugkeert naar de aarde geroepen?
Wat is allemaal vocht dat terugkeert naar de aarde geroepen?  Kun je bladeren en stengels op anijsplanten eten?
Kun je bladeren en stengels op anijsplanten eten?  De Taj Mahal is aan het wegkwijnen, en het kan binnenkort het point of no return bereiken
De Taj Mahal is aan het wegkwijnen, en het kan binnenkort het point of no return bereiken
Hoofdlijnen
- Wat is de functie van pacesettercellen?
- Welke morfologische interferentie en voorbeelden geven?
- Wat is de relatie tussen parasiet honingbijen en bijen?
- Wel of niet fokken? Trekkende vrouwelijke vlinders staan voor een moessondilemma
- Waarom worden cellen beschouwd als levend?
- Zou de micro-ecologie worden beschadigd door een plastic film die een schadelijk bodeminsect doodt?
- Wat is het classificatieniveau van aureus voor organisme Staphylococcus aureus?
- Wat is een selectief permeabel membraan en hoe werkt het?
- Welke wetenschapper geïsoleerd DNA voor het eerst?
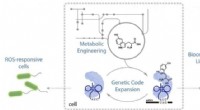
- Chemici breiden genetische code van E. coli uit om 21e aminozuur te produceren, het nieuwe vaardigheden geven
- Synthetische nanokanalen voor jodidetransport
- Ontwerpmateriaal om plastic buiten de vuilstort te houden
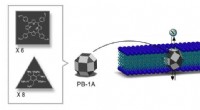
- Ontwerpen van hiërarchische nanoporeuze membranen voor zeer efficiënte adsorptie- en opslagtoepassingen

- Sproeidrogen - perfecte dosering dankzij medicijncapsules
 Science Projects With Balloons & Sound Vibration
Science Projects With Balloons & Sound Vibration  Hoe noem je een ster die lijkt te pulseren?
Hoe noem je een ster die lijkt te pulseren?  Evolutie van dennennaalden helpt bomen omgaan met regenval
Evolutie van dennennaalden helpt bomen omgaan met regenval Opgroeien in een bankwoestijn brengt grote kosten met zich mee
Opgroeien in een bankwoestijn brengt grote kosten met zich mee Welke planeten in het zonnestelsel zijn qua grootte het meest vergelijkbaar?
Welke planeten in het zonnestelsel zijn qua grootte het meest vergelijkbaar?  Hoe we de ouderdom van grotten in Cradle Humankind hebben berekend – en waarom dit ertoe doet
Hoe we de ouderdom van grotten in Cradle Humankind hebben berekend – en waarom dit ertoe doet  Als je van grote hoogte het water raakt, zal de impact je dan doden?
Als je van grote hoogte het water raakt, zal de impact je dan doden?  Droogte in Tsjechië zichtbaar vanuit de ruimte
Droogte in Tsjechië zichtbaar vanuit de ruimte
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

