
Wetenschap
Wat is de empirische formule en moleculair van een verbinding met molaire massa 245.8G de samenstelling 19.53 C 2.44 H 13.02 O 65.01 Br?
1. Empirische formule
* Ga uit van een 100 g monster: Hierdoor worden de percentages direct vertaald naar grams.
* Converteer grams in mollen: Verdeel de massa van elk element door zijn molaire massa:
* C:19.53 g / 12.01 g / mol =1.626 mol
* H:2,44 g / 1.01 g / mol =2,416 mol
* O:13.02 g / 16.00 g / mol =0,814 mol
* Br:65.01 g / 79,90 g / mol =0,813 mol
* Zoek de eenvoudigste verhouding tussen het hele nummer: Verdeel elke molwaarde door de kleinste molwaarde (0,813 mol):
* C:1.626 mol / 0,813 mol ≈ 2
* H:2.416 mol / 0,813 mol ≈ 3
* O:0,814 mol / 0,813 mol ≈ 1
* Br:0,813 mol / 0,813 mol ≈ 1
* Empirische formule: De empirische formule is c₂h₃obr
2. Moleculaire formule
* Bereken de empirische formulemassa: (2 * 12.01) + (3 * 1.01) + 16.00 + 79.90 =138,95 g/mol
* Bepaal de verhouding tussen de moleculaire massa en empirische formulemassa: 245,8 g/mol/138,95 g/mol ≈ 1.77
* Vermenigvuldig de subscripts in de empirische formule met de verhouding: Omdat de verhouding bijna 1,77 ligt, kunnen we deze ronddraaien naar 2.
* C₂h₃obr * 2 = c₄h₆o₂br₂
Daarom is de empirische formule c₂h₃obr en de moleculaire formule is c₄h₆o₂br₂.
 Slime maken zonder borax of vloeibare zetmeel
Slime maken zonder borax of vloeibare zetmeel  Eeuwenoud probleem opgelost met allereerste 3D-atomaire beeldvorming van een amorfe vaste stof
Eeuwenoud probleem opgelost met allereerste 3D-atomaire beeldvorming van een amorfe vaste stof Wat is het verschil tussen rode en groene dieselbrandstof?
Wat is het verschil tussen rode en groene dieselbrandstof?  Is er slechts één opgeloste stof in een oplossing?
Is er slechts één opgeloste stof in een oplossing?  Wat zijn de reactanten van een enzym-gekatalyseerde reactie bekend als?
Wat zijn de reactanten van een enzym-gekatalyseerde reactie bekend als?
 Wat is het eenvoudigste levende ding?
Wat is het eenvoudigste levende ding?  Arctic heeft een van de warmste jaren, angst aanwakkeren over stijgende zeespiegel
Arctic heeft een van de warmste jaren, angst aanwakkeren over stijgende zeespiegel De oerbossen van Europa:wat moeten we beschermen? herstellen?
De oerbossen van Europa:wat moeten we beschermen? herstellen?  Hoe op de natuur gebaseerde oplossingen effectief overstromingsbeheer kunnen bevorderen
Hoe op de natuur gebaseerde oplossingen effectief overstromingsbeheer kunnen bevorderen  Arizonas Whiting Knoll-vuur gezien door NASA-NOAA-satelliet
Arizonas Whiting Knoll-vuur gezien door NASA-NOAA-satelliet
Hoofdlijnen
- Nieuwe interactieve technologie maakt zeldzame celtypes zichtbaar
- Wat is een indicatororganismen?
- Hoe krijgen mensen zuurstof in hun lichaam?
- Van de vier klassen van biologisch significante macromoleculen zijn een die voor de meeste organismen voor de meeste organismen voor de belangrijkste bron -energie leveren?
- In welke functionele groep zou lignine natuurlijk vallen?
- Nu weten we waarom wortels oranje zijn
- Wat is een voorbeeld van een protistenorganisme?
- Wat is een basisprincipe van kinesiologie?
- Welke delen van de cel kun je onder een microscoop* zien?
- Veranderingen in de bacteriële celwand produceren meer vetmoleculen
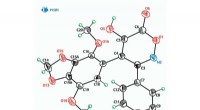
- Antibacteriële prodrug door zich te richten op intracellulaire metaboliet

- Chemici vereenvoudigen de synthese van antitumorverbindingen
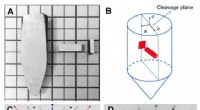
- Hoe gemeenschappelijke elementen een meer energiezekere toekomst kunnen maken

- Hoge thermo-elektrische prestaties in goedkope SnS0.91Se0.09-kristallen
 Waarom zou je worden geïnjecteerd met oplosbaar voedsel?
Waarom zou je worden geïnjecteerd met oplosbaar voedsel?  Een geheim, formule met twee noten trekt harten in films
Een geheim, formule met twee noten trekt harten in films Aardverschuivingen bedreigen de armen in de steden in toenemende mate
Aardverschuivingen bedreigen de armen in de steden in toenemende mate Stof kan de oude menselijke beschaving hebben beheerst
Stof kan de oude menselijke beschaving hebben beheerst Wat is de wetenschappelijke term voor apparatuur die een wetenschappelijk experiment samenstelt?
Wat is de wetenschappelijke term voor apparatuur die een wetenschappelijk experiment samenstelt?  Veiligheidsrecord Boeing 737 MAX in twijfel getrokken na twee tragedies
Veiligheidsrecord Boeing 737 MAX in twijfel getrokken na twee tragedies 2022 vestigt recordbrandactiviteit in Zuidwest-Europa:EU
2022 vestigt recordbrandactiviteit in Zuidwest-Europa:EU Radiogolven detecteren deeltjesdouches in een blok plastic
Radiogolven detecteren deeltjesdouches in een blok plastic
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

