
Wetenschap
Antibacteriële prodrug door zich te richten op intracellulaire metaboliet
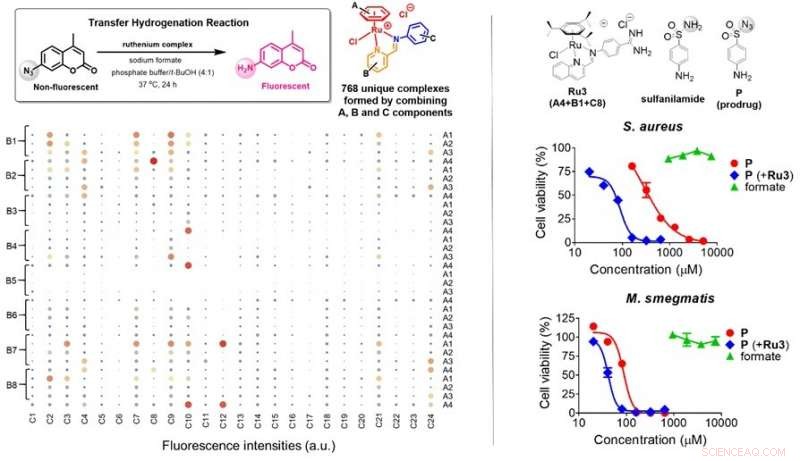
(Links) In totaal 768 (4x8x24) unieke rutheniumcomplexen werden gegenereerd via zelfassemblagereacties met behulp van moleculaire componenten A (4 soorten), B (8 soorten) en C (24 soorten) in waterige oplossingen, vervolgens gescreend op transferhydrogeneringsactiviteiten in aanwezigheid van formiaat. De grootte van de gearceerde cirkels geeft de werkzaamheid aan van rutheniumcomplexen bij het uitvoeren van overdrachtshydrogenering op de sonde, wat leidt tot het inschakelen van de fluorescentie. Er werden zes mogelijke kandidaten geïdentificeerd. (Rechts) Antibacteriële eigenschappen van prodrug P (rood) in S. aureus en M. smegmatis werden ingeschakeld in aanwezigheid van Ru3 (blauw) terwijl suppletie van formaat (groen) geen effect had op de bacteriegroei. Ru3, geassembleerd met behulp van A4, B1 en C8, was in staat om formaat aanwezig in bacteriecellen te gebruiken om P te activeren. Krediet: Internationale editie van Angewandte Chemie
Onderzoekers van de National University of Singapore hebben een aanpak ontwikkeld om pathogene bacteriën selectief aan te pakken door gebruik te maken van een intracellulaire metaboliet die bekend staat als formiaat, overvloedig aanwezig in deze bacteriën, als een nieuwe antimicrobiële strategie. Formaat is een essentiële metaboliet die nodig is voor groei in bepaalde pathogene stammen, maar wordt alleen in kleine hoeveelheden aangetroffen in zoogdiercellen.
De overvloed en het evoluerende pathogene gedrag van bacteriële micro-organismen leiden tot antibioticatolerantie en resistentie, die een gevaar vormen voor de mondiale volksgezondheid. Er zijn daarom nieuwe therapeutische strategieën nodig om gelijke tred te houden met deze groeiende dreiging.
Het onderzoeksteam onder leiding van Prof Ang Wee Han van de afdeling Chemie, NUS stelde een nieuwe benadering voor om bacteriën te targeten door formiaat, een celmetaboliet die alleen in bepaalde bacteriesoorten wordt aangetroffen, om een antibacteriële prodrug te activeren en selectief de groei van bacteriën te remmen. De onderzoekers ontwikkelden een moleculair kooisysteem voor sulfonamide-antibacteriële geneesmiddelen door hun essentiële amidefunctiegroep te vervangen door azide (N 3 - ). Ze vonden ook een waterstabiele verbinding (organorutheniumcomplex) die deze antibacteriële geneesmiddelen onder bepaalde omstandigheden kan afgeven na screening door 768 unieke rutheniumcomplexen. Wanneer samen gebruikt, de antibacteriële geneesmiddelen worden afgegeven in aanwezigheid van endogeen formaat dat in bacteriële cellen wordt aangetroffen. Deze strategie maakte gebruik van formaat, een noodzakelijk ingrediënt voor bacteriegroei, als een wapen om sulfonamide-prodrugs te activeren met behulp van rutheniumcomplexen die door de onderzoekers zijn ontwikkeld.
Prof Ang zei:"Dit is het eerste rapport dat unieke cellulaire metabolieten gebruikt om prodrug-activering in bacteriën te activeren. Het maakt de weg vrij voor een nieuwe benadering van gerichte antibacteriële therapie door gebruik te maken van verschillen in het voorkomen van natuurlijke metabolieten tussen pathogene stammen."
De rationeel ontworpen sulfonamide-prodrug met een azide-kooigroep werd efficiënt geactiveerd door de organoruthenium-complexen in formiaat-overvloedige bacteriën met een tot 8-voudige verbetering van de geneesmiddeleffectiviteit, vooral in de pathogene bacteriën, Staphylococcus aureus en Escherichia coli. In tegenstelling tot, verhoging van de werkzaamheid bij Mycobacterium smegmatis, die een beperkte capaciteit voor het genereren van formaten heeft, slechts verdubbelt. Dit valideerde de stelling dat intracellulaire metabolietformiaat het doelwit kan zijn voor de ontwikkeling van nieuwe antibacteriële therapeutische strategieën.
Prof Ang zei:"Antibioticaresistentie is een van de meest serieuze uitdagingen waarmee de mensheid wordt geconfronteerd en toch heeft de ontwikkeling van nieuwe antibiotica geen gelijke tred gehouden met deze groeiende dreiging. Het unieke bacteriële metaboloom biedt nieuwe mogelijkheden om dit probleem aan te pakken. We hopen dat deze ontdekking een aanzet zal zijn voor nieuw onderzoek gericht op verschillende metabolieten voor de ontwikkeling van betere en selectievere antibacteriële middelen."
Het onderzoeksteam werkt aan de ontwikkeling van andere prodrug-activeringsstrategieën die endogeen bacterieel formaat kunnen benutten. In aanvulling, onderzoeken naar andere klinische antibiotica zoals trimethoprim en sulfamethoxazol zijn ook aan de gang.
 Nieuw ultradun materiaal voor het splitsen van water kan waterstofproductie goedkoper maken
Nieuw ultradun materiaal voor het splitsen van water kan waterstofproductie goedkoper maken Eigenschappen van natuurlijk en synthetisch rubber
Eigenschappen van natuurlijk en synthetisch rubber Doorbraak in het benutten van de kracht van biologische katalysatoren
Doorbraak in het benutten van de kracht van biologische katalysatoren Onderzoekers rapporteren allereerste eiwithydrogels gemaakt in levende cellen
Onderzoekers rapporteren allereerste eiwithydrogels gemaakt in levende cellen Verschillen van natriumhydroxide versus Natriumcarbonaat
Verschillen van natriumhydroxide versus Natriumcarbonaat
 Klimaatconferentie Bangkok slaat alarm in aanloop naar VN-top
Klimaatconferentie Bangkok slaat alarm in aanloop naar VN-top Lezen tussen de diamanten:wetenschappers breiden diep koolstofverhaal uit
Lezen tussen de diamanten:wetenschappers breiden diep koolstofverhaal uit Major State of the Planet-rapport voorafgaand aan de eerste Nobelprijstop
Major State of the Planet-rapport voorafgaand aan de eerste Nobelprijstop Modelleringsstrategie stelt wetenschappers in staat om manieren te onderzoeken om opwarming te beperken, bijwerkingen verminderen
Modelleringsstrategie stelt wetenschappers in staat om manieren te onderzoeken om opwarming te beperken, bijwerkingen verminderen Energiereuzen gaven $ 1 miljard uit aan klimaatlobby, PR sinds Parijs:waakhond
Energiereuzen gaven $ 1 miljard uit aan klimaatlobby, PR sinds Parijs:waakhond
Hoofdlijnen
- Sonic Kayaks:Milieumonitoring en experimentele muziek door burgers
- Episch taaie baobabbomen sterven af in Afrika
- Nieuwe sorghumcultivars kunnen duizenden liters ethanol produceren
- Zullen we binnenkort uitgestorven zijn?
- Studie onthult hoe de adelborst zijn paar uur lang in stand houdt
- Wat zijn de 4 kenmerken die biologen gebruiken om levende dingen te herkennen?
- Tribunelichten van 9/11 kunnen gevaarlijk zijn voor vogels studie zegt:
- Maak een lijst van de soorten informatie die gevonden kan worden door de sequentie van een DNA-molecuul te kennen Molecule
- Knoestige problemen in DNA
- De leiding nemen:onderzoekers werken samen om betere batterijen te maken

- Duurzame houtsponzen fungeren als groene sensoren voor mechanische belasting

- Onderzoekers rapporteren nieuwe oxyfluorideverbinding voor fotokatalyse
- Onderzoekers ontwikkelen micro-elektro-fluïdische sonde (MeFP) om cellen te isoleren en te modelleren
- Zeer gevoelige dopaminedetector maakt gebruik van 2D-materialen
 John Deere 4400 combineert specificaties
John Deere 4400 combineert specificaties  Hoe wiskunde vragen kan beantwoorden waar we nog niet aan hebben gedacht
Hoe wiskunde vragen kan beantwoorden waar we nog niet aan hebben gedacht GOES-S en GOES-T satellieten komen samen
GOES-S en GOES-T satellieten komen samen Vernietigen waterscooters de planeet?
Vernietigen waterscooters de planeet?  Hoe de hoek van een sector te berekenen
Hoe de hoek van een sector te berekenen How Do Hummingbirds Mate?
How Do Hummingbirds Mate?  De voordelen en nadelen van het Bacillus-expressiesysteem
De voordelen en nadelen van het Bacillus-expressiesysteem  Vroege waarschuwingen voor een onbeheersbaar klimaat
Vroege waarschuwingen voor een onbeheersbaar klimaat
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

