
Wetenschap
Wanneer fluor bindt met een ander element, doen de elektronen wat?
* Fluor krijgt een elektron: Fluor is zeer elektronegatief, wat betekent dat het een sterke aantrekkingskracht heeft op elektronen. Om een stabiele elektronenconfiguratie te bereiken, wil het één elektron krijgen.
* Het andere element verliest een elektron: Om tegemoet te komen aan de behoefte van fluor aan een elektron, verliest het andere element een elektron. Dit is meestal een metaal of een minder elektronegatief niet -metaal.
* Een ionische binding wordt gevormd: De resulterende ionen (een positief ion van het element dat een elektron verloor en een negatief ion van fluor) worden tot elkaar aangetrokken door elektrostatische krachten, waardoor een ionische binding wordt gevormd.
Voorbeeld:
Wanneer natrium (NA) reageert met fluor (F), verliest natrium een elektron om een positief geladen natriumion (Na+) te worden en fluor krijgt een elektron om een negatief geladen fluoride-ion te worden (F-). Deze ionen vormen vervolgens een ionische binding, waardoor natriumfluoride (NAF) ontstaan.
Opmerking:
Hoewel de bovenstaande beschrijving zich richt op ionische bindingen, kan fluor ook covalente bindingen vormen. Zelfs in covalente bindingen trekt het fluoratoom de gedeelde elektronen echter veel dichter bij zichzelf vanwege de hoge elektronegativiteit, waardoor een polaire covalente binding ontstaat.
 Wat is de chemische reactie met 2-butanol en azijnzuur?
Wat is de chemische reactie met 2-butanol en azijnzuur?  Nieuwe inkjetprintmethode kan het ontdekken van medicijnen en geprinte gepersonaliseerde medicijnafgifte versnellen
Nieuwe inkjetprintmethode kan het ontdekken van medicijnen en geprinte gepersonaliseerde medicijnafgifte versnellen Welk type chemische binding is MgO?
Welk type chemische binding is MgO?  Plantaardige eiwitten uitdrogen met de snelheid van het geluid
Plantaardige eiwitten uitdrogen met de snelheid van het geluid Het belang van een periodiek systeem
Het belang van een periodiek systeem
Hoofdlijnen
- Meerdere stressoren kunnen interactief leiden tot verslechtering van aquatische ecosystemen
- Hoe cellen worden verijdeld door een familielid van het herpesvirus in de wapenwedloop tussen virussen
- Wat te doen bij een hondenaanval en waarom ze postbodes zo haten
- Reguleren de longen de pH-balans?
- Hoe zijn peptiden en eiwitten vergelijkbaar?
- Waarom zijn stamcellen van belang?
- Welk type epitheel heeft langwerpige cellen met kernen?
- Zeeslakken weten hoe ze hun huisvestingskosten moeten begroten
- Uit onderzoek blijkt hoe vrouwtjes het 'juiste' sperma kiezen
- Activering met zichtbaar licht maakt transformatie van stabiele sulfonen naar waardevolle glycosiden mogelijk
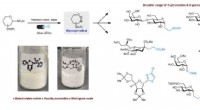
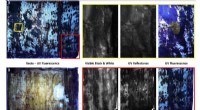
- Onderzoekers deconstrueren oud Joods perkament met behulp van meerdere beeldvormingstechnieken
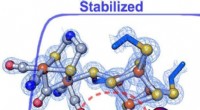
- Onderzoekers ontdekken hoe de enzymomgeving de snelheid en richting van een reactie verandert
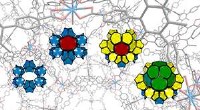
- Twee eenvoudige bouwstenen produceren complex 3D-materiaal
- Zelfaangedreven op papier gebaseerde SPED's kunnen leiden tot nieuwe medisch-diagnostische hulpmiddelen

 State of the art:Museum werpt hi-tech blik op Vermeer
State of the art:Museum werpt hi-tech blik op Vermeer Hoe Iapetus aan zijn heuvelrug kwam
Hoe Iapetus aan zijn heuvelrug kwam  Recessie? Welke recessie? Vakbondsvorming op staats- en lokaal niveau
Recessie? Welke recessie? Vakbondsvorming op staats- en lokaal niveau  Nieuw onderzoek vindt dat oceanische opwelling eerdere theorieën tart
Nieuw onderzoek vindt dat oceanische opwelling eerdere theorieën tart Galileo sluit zich aan bij snelgroeiende navigatiemarkt
Galileo sluit zich aan bij snelgroeiende navigatiemarkt Eerste experimenteel bewijs voor superionisch ijs
Eerste experimenteel bewijs voor superionisch ijs Hoe torenkranen werken
Hoe torenkranen werken  Het gekke beest dat tussen de dinosaurussen leefde
Het gekke beest dat tussen de dinosaurussen leefde
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

