
Wetenschap
Onderzoekers ontdekken hoe de enzymomgeving de snelheid en richting van een reactie verandert
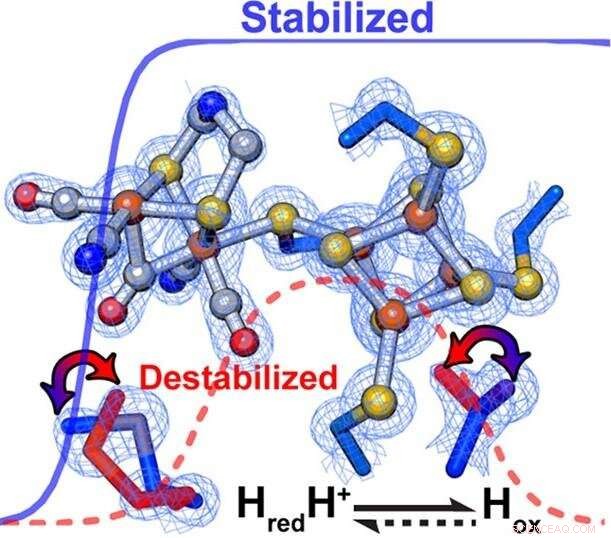
Onderzoekers ontdekten dat subtiele veranderingen in de eiwitstructuur rond het katalytische centrum van een enzym de snelheid en richting van chemische reacties voortreffelijk regelen. Binnen [FeFe]-hydrogenasen, secundaire interacties hadden een directe invloed op de relatieve stabilisatie/destabilisatie van verschillende oxidatietoestanden van de metaalcluster op de actieve plaats. Krediet:PNNL
Terwijl onderzoekers zoeken naar manieren om alledaagse producten te ontwikkelen en te verbeteren, variërend van brandstof tot medicijnen, enzymen bieden het voorbeeld van de natuur van de controle die nodig is om chemische reacties op de gewenste manier te laten werken. Maar een fenomeen dat bekend staat als katalytische vooringenomenheid, blijft wetenschappers overrompelen.
De eiwitstructuur rond de katalytische kern van een enzym regelt voortreffelijk de reactiviteit, inclusief de richting en snelheid van chemische processen. Wetenschappers noemen deze fijnafstemming "katalytische vooringenomenheid" - en hoe het gebeurt, blijft veel besproken.
Het mysterie is een stap dichter bij de oplossing.
Een onderzoeksteam van drie nationale laboratoria van het Amerikaanse Department of Energy (DOE) en vier universiteiten ontdekte dat subtiele veranderingen in de omgeving rond sommige enzymen niet alleen de snelheid van een cellulaire reactie met maar liefst zes orden van grootte kunnen veranderen, maar ook de richting ervan. Die omkering - de wortel van het katalytische vooringenomenheidsdilemma - is als te hard rijden in één richting met 10 mijl per seconde, dan in de tegenovergestelde richting op 1, 000, 000 mijl per seconde. De kloof loopt snel op.
“Afhankelijk van het gewenste resultaat, de vooringenomenheid kan onoverkomelijk zijn of een van de beste dingen die ooit kunnen gebeuren, " zei Simone Raugei, een computationele wetenschapper bij PNNL en co-auteur van het onderzoek. "Een reactie kan veel tussenproducten hebben en kan meerdere routes volgen - sommige efficiënter dan andere. Dus het kunnen afstemmen van de katalysatoromgeving kan een opmerkelijk verschil maken in de reactiesnelheid."
De bevindingen, gerapporteerd in de Tijdschrift van de American Chemical Society , belangrijke implicaties hebben voor het ontwerp van synthetische katalysatoren die worden gebruikt in industriële omgevingen, waarbij het voorspellen en beheersen van het gedrag van een reactie van cruciaal belang is. De resultaten bieden ook een beter fundamenteel begrip van de factoren die metabolische processen in al het leven beheersen.
Katalytische bias in metallo-enzymen
In de natuur, de microbe Clostridium pasteurianum (Cp) produceert verschillende op ijzer gebaseerde enzymen, [FeFe]-hydrogenasen, die behoren tot een grote groep metallo-enzymen. Metallo-enzymen zijn betrokken bij een groot aantal reacties die vele functies vervullen, zoals het verplaatsen van waterstof door microbiële gemeenschappen, stikstof uit de lucht halen, methaan produceren, en het omzetten van koolhydraten.
De veelzijdigheid maakt de metalloenzymen, en [FeFe]-hydrogenasen specifiek, ideale onderwerpen voor het onderzoeken van fundamentele vragen met betrekking tot chemische transformaties. In feite, hydrogenasen zijn de inspiratiebron geweest voor talrijke onderzoeken naar elektrokatalyse in energieomzettingsreacties, gefinancierd door het DOE's Office of Basic Energy Sciences, zei Morris Bullock, directeur van het Centrum voor Moleculaire Elektrokatalyse, een DOE Energy Frontier Research Center.
"Ontdekkingen gerapporteerd door verschillende onderzoeksgroepen met behulp van complementaire benaderingen verrijken ons begrip van de fundamentele wetenschappelijke basis van katalyse door zowel biologische als moleculaire systemen, ' zei Bullock.
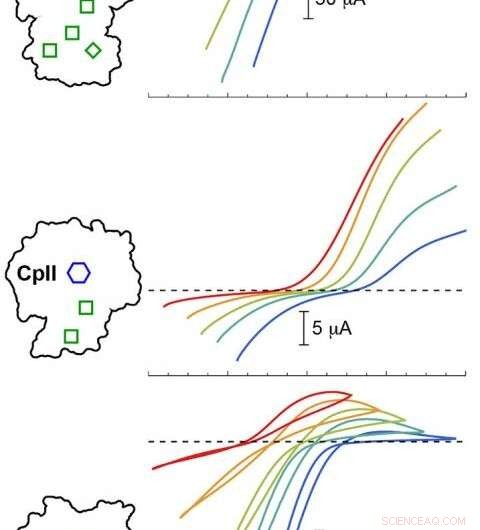
PNNL computationele modellering gevalideerde experimenten met drie Cp-hydrogenasen bij verschillende pH-waarden. De resultaten toonden aan dat het katalytische potentieel (gekleurde curven) varieerde afhankelijk van de opstelling van de H-cluster (blauwe zeshoek) en accessoireclusters (groene dozen). Gekleurde sporen onder de stippellijn komen overeen met waterstofproductie, terwijl sporen boven de stippellijn overeenkomen met waterstofoxidatie. Credit: J. Ben. Chem. Soc . 2020, 142, 3, 1227-1235
John Peters, de gezamenlijk aangestelde PNNL, is professor aan de Washington State University (WSU) en directeur van Biological and Electron Transfer and Catalysis, een ander DOE Energy Frontier Research Center. Peters begon eind jaren negentig met het bestuderen van [FeFe]-hydrogenasen met behulp van enzymen uit de Cp-microbe. Maar die eerdere studies waren gericht op algemene mechanistische aspecten, en pas onlangs zijn onderzoekers begonnen na te denken over enzymen in de context van katalytische vooringenomenheid.
Peters en Paul Koning, manager van de Physical Biochemistry and Photosynthesis Group bij het National Renewable Energy Laboratory (NREL), co-ontworpen de nieuwe studie met Raugei bij PNNL en Anne Jones, een universitair hoofddocent aan de School of Molecular Sciences aan de Arizona State University (ASU).
De studie had tot doel te identificeren hoe drie [FeFe]-hydrogenasen verschillen in het beheersen van zowel protonreductie tot moleculaire waterstof, evenals de omgekeerde reactie-oxidatie van moleculaire waterstof tot protonen. Elke zogenaamde redoxreactie speelt een cruciale rol bij biologische energieoverdracht en is uitgebreid bestudeerd voor energieopslag- en productietoepassingen.
Elektrostatica finetunen reactietussenproducten
De studie van de katalytische activiteit van de drie [FeFe]-hydrogenasen omvatte een krachtige combinatie van experimentele benaderingen bij tal van onderzoeksfaciliteiten en uitgevoerd door wetenschappers van WSU, NREL en ASU. Raugei, ook een gezamenlijke aangestelde bij WSU, leidde het theoretische en computationele modelleringsteam, wiens taak het was om de experimentele waarnemingen uit te zoeken en een theoretisch model voor het enzymatische mechanisme te ontwikkelen.
Het onderzoeksteam gebruikte nauwkeurige metingen van röntgenstralen in de Linac Coherent Light Source-faciliteit, gelegen aan de Stanford Synchrotron Radiation Lightsource, om de atomaire structuur van het enzym te analyseren. Volgende, onderzoekers van ASU onderwierpen het enzym aan een elektrische stroom om de elektrokatalytische activiteit van elke hydrogenase in zowel rustende als actieve toestand te onderzoeken. Alle enzymen deelden een identieke katalytische cluster van ijzer- en zwavelatomen - in het algemeen de H-Cluster genoemd - maar verschilden in de samenstelling van de omringende eiwitomgeving.
De onderzoekers merkten significante verschillen op in de reactiebias tussen de drie hydrogenasen. Vervolgens, tijdens feedbackloops tussen de experimenten en computationele modellering, subtiele veranderingen in het elektrostatische veld rond het katalytische centrum trokken de aandacht van het team.
"We zagen inderdaad dat als het veld werd veranderd, we waren in staat om de reactie op de een of andere manier gunstiger te maken om te proberen de experimentele waarneming te verklaren, " zei Raugei. De subtiele verschillen in de omgeving, hij zei, bepaalde de richting van de reactie onder stabiele omstandigheden en verfijnde de reactiesnelheid.
Volgens koning, de selectieve stabilisatie of destabilisatie van katalytische tussenproducten die bij voorkeur waterstofoxidatie of protonreductie bevorderen. specifiek, een meer hydrofobe omgeving rond de H-Cluster stemde het enzym af om bij voorkeur waterstofproductie te bevorderen, terwijl waterstofoxidatie werd bevorderd door een minder hydrofobe omgeving.
"Dit werk, " zei koning, "onthult de kracht van biologie om de reactiviteit van metallo-enzymen te beheersen om te voldoen aan de unieke metabolische processen in al het leven en biedt waardevol nieuw inzicht voor het ontwerp van verbeterde elektrokatalytische platforms."
Peters zei dat de ontwerpkenmerken die [FeFe]-hydrogenasen gebruiken om de reactiviteit af te stemmen en te controleren, waarschijnlijk worden gedeeld door andere biokatalysatoren op metalen locaties. De onderzoekers zijn van plan hun model te verfijnen om een meer algemene blauwdruk te bieden voor het begrijpen van katalytische vooringenomenheid in de grotere klasse van redox-enzymen - en de metabolische energie die al het leven aandrijft.
 Onderzoekers bepalen actieve plaatsen van Cu-znO-katalysatoren voor watergasverschuiving en CO-hydrogeneringsreacties
Onderzoekers bepalen actieve plaatsen van Cu-znO-katalysatoren voor watergasverschuiving en CO-hydrogeneringsreacties Klimaatvriendelijke architectuur dankzij natuurlijke vouwmechanismen
Klimaatvriendelijke architectuur dankzij natuurlijke vouwmechanismen Residuen in vingerafdrukken bevatten aanwijzingen voor hun leeftijd
Residuen in vingerafdrukken bevatten aanwijzingen voor hun leeftijd Onderzoeker ontwikkelt methode om fundamentele architectuur van polymeren te veranderen
Onderzoeker ontwikkelt methode om fundamentele architectuur van polymeren te veranderen Nieuw katalytisch effect ontdekt voor de productie van galliumoxide
Nieuw katalytisch effect ontdekt voor de productie van galliumoxide
 De waarheid over bioplastics
De waarheid over bioplastics Desert Ecosystems for Kids
Desert Ecosystems for Kids De huidige toezeggingen om steenkoolstroom uit te faseren zijn kritisch onvoldoende om de klimaatverandering te vertragen
De huidige toezeggingen om steenkoolstroom uit te faseren zijn kritisch onvoldoende om de klimaatverandering te vertragen Satelliet ziet Oostelijke Stille Oceaan Depressie 10E vorm
Satelliet ziet Oostelijke Stille Oceaan Depressie 10E vorm NASA ziet de overblijfselen van tropische cycloon Debbie voor de oostkust van Australië bewegen
NASA ziet de overblijfselen van tropische cycloon Debbie voor de oostkust van Australië bewegen
Hoofdlijnen
- Hoe werkt het spierstelsel met de bloedsomloop?
- Wat zijn enkele kenmerken van DNA?
- Stadia van ecologische successie
- Dit is waarom Fortnite zo verslavend is
- Team publiceert onderzoek naar ongewone genevolutie in bacteriën
- Wat doet Choline voor het lichaam?
- Toevallige registratie van een jaarlijkse massale opkomst van raadselachtige bidsprinkhanenvliegen
- Burgerwetenschap kan de betrokkenheid en het begrip bij niet-gegradueerde biologielessen vergroten
- Hoe de hormonen van de hypofyse te onthouden
- Imperfectie is OK voor betere MOF's

- Precisie-experimenten onthullen hiaten in de theorie van Van der Waals
- Wetenschappers onthullen dubbele specificiteit van Vav2-SH2-eiwit
- Zwemmende microbots kunnen ziekteverwekkende bacteriën uit water verwijderen

- Verslaving behandelen:Cryo-EM-technologie maakt het onmogelijke mogelijk
 President Obama krijgt onafhankelijkheidsverklaringen van nanoformaat
President Obama krijgt onafhankelijkheidsverklaringen van nanoformaat Maanstof verzameld door Neil Armstrong wordt geveild in NY
Maanstof verzameld door Neil Armstrong wordt geveild in NY Zonnecellen met nieuwe interfaces
Zonnecellen met nieuwe interfaces Definitie van een landecosysteem
Definitie van een landecosysteem
Een ecosysteem op het land of op het land is alle levende organismen en hun fysieke omgeving op een bepaald stuk land. Terrestrische ecosystemen kunnen interageren en overlappen met mariene (zoutwater) en limnologis
 Ontdekking van een mijlpaal in instabiliteit van gouden nanostaafjes
Ontdekking van een mijlpaal in instabiliteit van gouden nanostaafjes Lava overspoelt 100 huizen terwijl vulkaan Canarische Eilanden uitbarst
Lava overspoelt 100 huizen terwijl vulkaan Canarische Eilanden uitbarst China's FAST-radiotelescoop van 500 meter is nu operationeel
China's FAST-radiotelescoop van 500 meter is nu operationeel Cycloon treft kust Oost-India
Cycloon treft kust Oost-India
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

