
Wetenschap
Is een ontledingsreactie bijna hetzelfde als synthesereactie?
Hier is de uitsplitsing:
Ontledingsreactie:
* Definitie: Een enkele reactant breekt uit in twee of meer producten.
* Algemene vorm: AB → A + B
* Voorbeeld: De ontleding van water in waterstof en zuurstof:2h₂o → 2h₂ + o₂
Synthesereactie:
* Definitie: Twee of meer reactanten combineren om een enkel product te vormen.
* Algemene vorm: A + B → AB
* Voorbeeld: De synthese van water uit waterstof en zuurstof:2h₂ + o₂ → 2h₂o
Belangrijkste verschillen:
* reactanten en producten: Decompositiereacties beginnen met één reactant en eindigen met meerdere producten, terwijl synthesereacties beginnen met meerdere reactanten en eindigen met één product.
* Energieverandering: Decompositiereacties vereisen meestal energie -input (endotherm), terwijl synthesereacties vaak energie vrijgeven (exotherme).
Samenvattend is ontleding het omgekeerde van de synthese. Ze zijn niet hetzelfde, maar eerder twee tegengestelde soorten chemische reacties.
 Heeft een ionenatoom of molecuul elektrische lading?
Heeft een ionenatoom of molecuul elektrische lading?  Hoe vergelijkt het vermogen om natriumbenzoaat te proeven Abilty PTC of Thiourea?
Hoe vergelijkt het vermogen om natriumbenzoaat te proeven Abilty PTC of Thiourea?  Is aluminiumoxide metaal of een niet-metaal?
Is aluminiumoxide metaal of een niet-metaal?  Koolstofkredieten zijn nuttig voor het stabiliseren van het klimaat, maar worden ze ook effectief gebruikt?
Koolstofkredieten zijn nuttig voor het stabiliseren van het klimaat, maar worden ze ook effectief gebruikt?  Hoe label je een Bohr-model voor scandium?
Hoe label je een Bohr-model voor scandium?
 Welk ecosysteem domineert het grootste deel van Mongolië?
Welk ecosysteem domineert het grootste deel van Mongolië?  Cloud computing kan verborgen uitstoot van broeikasgassen veroorzaken
Cloud computing kan verborgen uitstoot van broeikasgassen veroorzaken Onderzoek van bergen afgebeeld in Tableau Physique onthult fouten, impact van klimaatverandering
Onderzoek van bergen afgebeeld in Tableau Physique onthult fouten, impact van klimaatverandering Giftige sites in waarschijnlijk pad van Irma
Giftige sites in waarschijnlijk pad van Irma Wetenschappers lossen puzzel over luchtkwaliteit op:waarom blijft ozon lang hangen na het verbod?
Wetenschappers lossen puzzel over luchtkwaliteit op:waarom blijft ozon lang hangen na het verbod?
Hoofdlijnen
- Hoe we een zeldzaam gigantisch duizendpootfossiel ontdekten op een strand, en waarom het ertoe doet
- Wat is de formule voor productwetgeving in de biologie?
- Beoordeling van op SERS gebaseerde sensoren voor landbouwtoepassingen
- Wat betekent door wetenschapstechnologie en superstation te definiëren?
- Hoe cellen blijven groeien, zelfs als ze worden aangevallen
- Duizenden johannesbroodbomen geplant terwijl Cyprus het zwarte goud doet herleven
- Wat is een organisme dat langzaam groeit in de kou, maar een optimale groeitemperatuur van 32 graden Celsius heeft?
- Welke streng mRNA zou worden geproduceerd uit het hieronder getoonde DNA?
- Wat doet de kern voor cel?
- Onderzoekers valideren klinische haalbaarheid voor op CRISPR gebaseerde COVID-19-tests op het zorgpunt
- De weg verlichten naar poreuze elektronica en sensoren

- Zou de hitte van de aardkorst de ultieme energiebron kunnen worden?

- De knoestige kwestie van het aroma van zachte krakeling oplossen
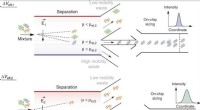
- Microfluidics:2D-vingerafdrukken van heterogene eiwitten in oplossing
 Studie werpt meer licht op de aard van de voorbijgaande röntgenpulsar MAXI J1409-619
Studie werpt meer licht op de aard van de voorbijgaande röntgenpulsar MAXI J1409-619 Een isotone oplossing voor menselijke rode bloedcellen is een?
Een isotone oplossing voor menselijke rode bloedcellen is een?  Waarom gebruiken we een dubbele pijl in de dissociatievergelijking voor zwak zuur?
Waarom gebruiken we een dubbele pijl in de dissociatievergelijking voor zwak zuur?  Op licht gebaseerde productie van moleculen voor het ontdekken van geneesmiddelen
Op licht gebaseerde productie van moleculen voor het ontdekken van geneesmiddelen Onderzoekers ontdekken waarom goud naast arseen geconcentreerd is
Onderzoekers ontdekken waarom goud naast arseen geconcentreerd is  Vlieg me (gedeeltelijk) naar de maan
Vlieg me (gedeeltelijk) naar de maan Een huis bedrukken van een nieuw veenmateriaal
Een huis bedrukken van een nieuw veenmateriaal NASA's Curiosity Marsrover vindt een kleicache
NASA's Curiosity Marsrover vindt een kleicache
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

