
Wetenschap
Hoe label je een Bohr-model voor scandium?
| Energieniveau | Aantal elektronen |
|---|---|
| K | 2 |
| L | 8 |
| M | 9 |
| N | 2 |
De kern bevindt zich in het midden van het atoom. De elektronenschillen worden aangeduid met K, L, M en N, beginnend bij de binnenste schil. Elke schil kan een maximaal aantal elektronen bevatten, zoals aangegeven in de tabel. De elektronen zijn binnen elke schaal in subschalen gerangschikt. De s-subshell kan maximaal 2 elektronen bevatten, de p-subshell kan maximaal 6 elektronen bevatten, de d-subshell kan maximaal 10 elektronen bevatten en de f-subshell kan maximaal 14 elektronen bevatten.
In scandium zijn de elektronen als volgt verdeeld:
* K-schaal:2 elektronen in de 1s-subschaal
* L-schaal:8 elektronen in de 2s- en 2p-subschalen
* M-schaal:9 elektronen in de 3s-, 3p- en 3d-subschalen
* N-schil:2 elektronen in de 4s-subschil
Het Bohr-model van scandium toont de rangschikking van elektronen in het atoom. De elektronen zijn gerangschikt in schillen rond de kern, waarbij elke schil een specifiek energieniveau heeft. De elektronen in de buitenste schil zijn het meest losjes gebonden aan de kern en zijn daarom het meest reactief.
 Filmtechnologie inspireert draagbare vloeistofeenheid die energie wil oogsten
Filmtechnologie inspireert draagbare vloeistofeenheid die energie wil oogsten Is citroenzuur zwaarder dan water?
Is citroenzuur zwaarder dan water?  Stabiliserende zilverfilms voor zeer efficiënte brandstofcellen
Stabiliserende zilverfilms voor zeer efficiënte brandstofcellen De transformatie van een paar:hoe elektronen de stroom in 'slechte metalen' supertransporteren
De transformatie van een paar:hoe elektronen de stroom in 'slechte metalen' supertransporteren  Experimentele observatie van de schaal van het elastische bereik in turbulente stroming met polymeeradditieven
Experimentele observatie van de schaal van het elastische bereik in turbulente stroming met polymeeradditieven
 Dam problemen, win-win-oplossingen
Dam problemen, win-win-oplossingen Hittegolven:waarom etnische minderheden in het VK kwetsbaarder zijn en wat eraan te doen
Hittegolven:waarom etnische minderheden in het VK kwetsbaarder zijn en wat eraan te doen Noord-Chinese steden verstikt door smog sluiten fabrieken, stop auto's (update)
Noord-Chinese steden verstikt door smog sluiten fabrieken, stop auto's (update) De meeste steden in de staat São Paulo hebben een laag potentieel om zich aan te passen aan klimaatverandering
De meeste steden in de staat São Paulo hebben een laag potentieel om zich aan te passen aan klimaatverandering Welvaart doodt de planeet, waarschuw wetenschappers
Welvaart doodt de planeet, waarschuw wetenschappers
Hoofdlijnen
- Wat is euchaebacteriën?
- Studie verklaart regionale verschillen in vogeldiversiteit in agroforestry-systemen
- Wat is endocytose en hoe ze werken?
- Wat de levendige pigmenten van vogelveren ons kunnen leren over hoe evolutie werkt
- Chimpansees bleken arm- en monduitdrukkingen te gebruiken om afstand over te brengen
- Hoe bacteriën eiwitten exploiteren om potentieel dodelijke infecties te veroorzaken
- Video:Moet je plassen op een kwallenbeet?
- Mysterieus cirkelgedrag van reuzenhaaien uitgelegd
- Differentiëren van RNA- en DNA-virussen
- Surrey bouwt AI om chemische verbindingen tegen veroudering te vinden

- Nieuwe glucagon-achtige peptide-1 medicijnen ontworpen voor diabetes type 2
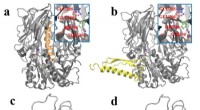
- Lab ontdekt kleine Kaïn-en-Abel-molecuul
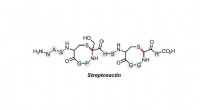
- Sterke M-M Pauli-afstoting leidt tot weerzinwekkende metalophiliciteit
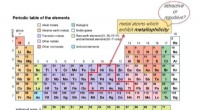
- Tubuline-remmer met een uniek moleculair werkingsmechanisme

 Pool Chloorsterkte in vergelijking met Huishoudbleek
Pool Chloorsterkte in vergelijking met Huishoudbleek  De reden voor het kleuren van een exemplaar op de microscoop
De reden voor het kleuren van een exemplaar op de microscoop  Team ontwikkelt zeer flexibele high-energy textiellithiumbatterij voor draagbare elektronica
Team ontwikkelt zeer flexibele high-energy textiellithiumbatterij voor draagbare elektronica De helderheid van nabije sterren kalibreren om berekeningen van de leeftijd en uitdijing van het heelal te verfijnen
De helderheid van nabije sterren kalibreren om berekeningen van de leeftijd en uitdijing van het heelal te verfijnen Zelfgebouwde Bowtie-resonatoren overbruggen de kloof tussen nanoscopisch en macroscopisch
Zelfgebouwde Bowtie-resonatoren overbruggen de kloof tussen nanoscopisch en macroscopisch  Muziekfestivals worden steeds meer getroffen door de klimaatverandering. Doet de industrie genoeg om de impact te verzachten?
Muziekfestivals worden steeds meer getroffen door de klimaatverandering. Doet de industrie genoeg om de impact te verzachten?  Nieuw elektrisch geactiveerd materiaal kan braillelezers verbeteren
Nieuw elektrisch geactiveerd materiaal kan braillelezers verbeteren Coronavirus is slechts een van de 10 catastrofale bedreigingen waarmee mensen momenteel worden geconfronteerd
Coronavirus is slechts een van de 10 catastrofale bedreigingen waarmee mensen momenteel worden geconfronteerd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

