
Wetenschap
Microfluidics:2D-vingerafdrukken van heterogene eiwitten in oplossing
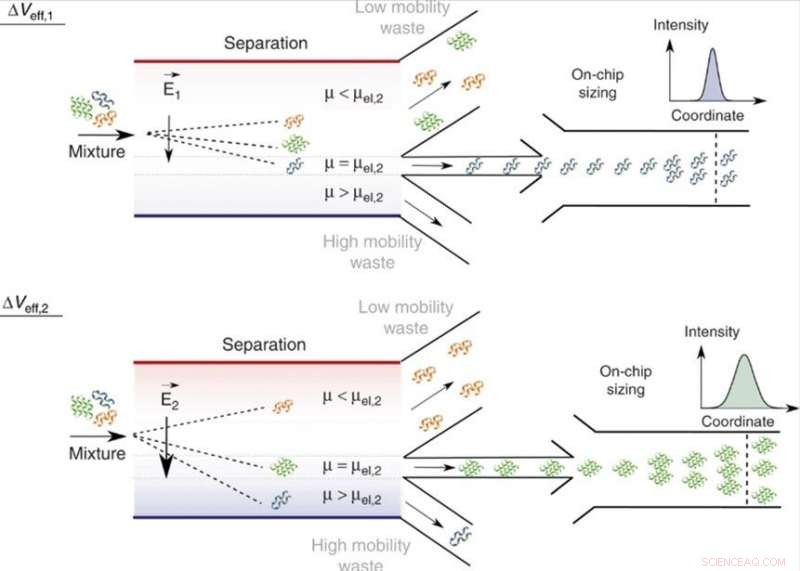
On-chip scheiding en analyse van mengsels in vloeibare fase. Door de effectieve spanning aan te passen, Veff, moleculen met een specifieke elektroforetische mobiliteit, μ = μel, en dus van een specifieke verhouding tussen lading en hydrodynamische straal, qRh, kunnen naar het analysegebied worden geleid met die met kleinere (μ < μel) en grotere (μ > μel) mobiliteitswaarden naar de afvalinzamelingskanalen. Omdat de aangelegde spanning kan worden gevarieerd, er is slechts een enkele analyse-eenheid nodig en de breedte van de scheidingskamer kan beperkt worden gehouden, waardoor het apparaat een hoge spanningsefficiëntie en een hoge verwerkingssnelheid behoudt. In het analysegebied de fracties worden op maat gemaakt door middel van microfluïdische diffusiemeting (MDS) door hun spatiotemporele beweging onder laminaire stromingsomstandigheden te volgen. Krediet:microsystemen en nano-engineering, doi:10.1038/s41378-019-0072-3
Microfluïdische systemen worden gebruikt in de moleculaire biologie, biochemie en biotechnologie om heterogene biomoleculaire mengsels snel te analyseren met hoge terugwinningspercentages en minieme monstervolumes. Echter, het is een uitdaging om voorbereidende en analytische processen te combineren binnen één apparaat voor snelle geïntegreerde analyse. In een recente studie die nu is gepubliceerd op Microsystemen en nano-engineering , Kadi L. Saar en medewerkers van de interdisciplinaire afdelingen scheikunde, natuurkunde, en Fluidic Analytics Limited in Cambridge, VK, hebben een chip ontwikkeld die de twee stappen van voorbereiding en analyse combineert.
aanvankelijk, ze gebruikten spanning om eiwitmoleculen te scheiden in een binair mengsel van biomoleculen van gelijke grootte die niet te onderscheiden zijn via conventionele meet- of oplossingstechnieken. Daarna, het onderzoeksteam gebruikte het nieuwe apparaat om een 2D-vingerafdruk van een heterogeen eiwitmengsel te verkrijgen. De resultaten zullen nieuwe mogelijkheden openen om op korte tijd snelle multiparametergegevens over biomoleculaire systemen te verkrijgen.
Microfluïdische technieken zijn aantrekkelijk om biologische monsters te analyseren vanwege de zeer lage monstervereisten en een hoog herstelpercentage. De platforms kunnen een onovertroffen analysesnelheid bieden op het niveau van afzonderlijke bedrijfseenheden of meerdere eenheden voorzien van een direct gecombineerde workflow, zonder monsteroverdracht tussen de eenheden. Dergelijke overdrachten vinden plaats via connectoren of buizen en introduceren dispersie in het monster, die de prestaties van het systeem beïnvloeden. De hierin voorgestelde workflow kan heterogene mengsels scheiden om de componenten van belang te bepalen en complexiteit te verminderen voor verdere verwerking van het mengsel voor de zuivering ervan.
Onderzoekers hadden eerder een verscheidenheid aan op continue stroom gebaseerde moleculaire scheidingsstrategieën op micronschaal geïntroduceerd, inclusief free-flow elektroforese, diëlektroforese, magnetoforese en akoestische scheiding. Detectiestrategieën zoals laser- of LED-geïnduceerde fluorescentie (LIF), chemiluminescentie of elektrochemische benaderingen kunnen parallel worden ingebed in dergelijke microfluïdische scheidingsplatforms. Analytische informatie over de gescheiden verbindingen kan worden verkregen met offline strategieën zoals massaspectroscopie of SDS-PAGE, maar de technieken kunnen de verwerkingssnelheid in een enkel apparaat beperken, monsterverlies of verontreiniging veroorzaken.
Saar et al. ontwikkelde daarom volledig geïntegreerde scheiding en kwantitatieve karakterisering van heterogene biomoleculaire monsters in een enkel microfluïdisch apparaat om de bestaande limieten te overwinnen door on-chip scheiding direct te koppelen aan on-chip analyse en moleculaire dimensionering. Het ontwerpkenmerk maakte de analyse van een specifieke fractie mogelijk door de toegepaste veldsterkte aan te passen. Ze ontwierpen het apparaat om gescheiden fracties te identificeren vergelijkbaar met SEC-MALS (grootte-uitsluitingschromatografie met multi-angle lichtverstrooiing) of LC (chip)-MS ((on-chip)-vloeistofchromatografie-massaspectrometrie) methoden.
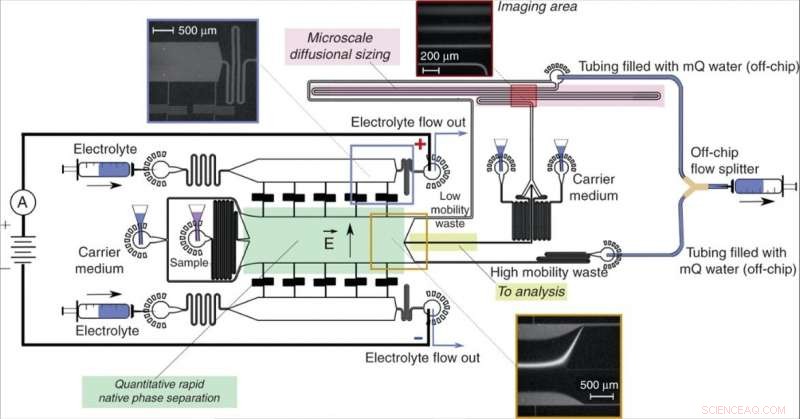
Apparaatontwerp en bediening. Een free-flow elektroforese-eenheid (groen), waardoor een snelle scheiding van analytmoleculen in hun oorspronkelijke fase mogelijk is en kwantitatieve informatie over het scheidingsproces wordt verkregen, gerichte fracties van het monster (geel) naar een stroomafwaarts analyseproces met microfluïdische diffusie-afmetingen (MDS; roze). Het monster werd gekenmerkt door het volgen van een enkel beeldvormingsframe (inzet rechtsboven) om tegelijkertijd de afmetingen en de ladingen van de gescheiden fracties te extraheren. Het apparaat werd bediend door een negatieve druk aan de uitlaat toe te passen met een Y-vormige off-chip stroomsplitser die de oplossingen van de kanalen "low mobility waste" en "high mobility waste" gescheiden hield om gedeeltelijke kortsluiting van het apparaat te voorkomen. De elektrische potentiaal werd aangelegd vanuit de uitlaten van de elektrolytoplossing met behulp van een stromende elektrolytoplossing zoals eerder beschreven . De stroom van de elektrolytoplossing, die een fluorescerende tracer bevatte voor de visualisatie, zodanig is gekozen dat de elektrolyt de uitlaat zou bereiken in plaats van in de scheidingskamer te worden teruggetrokken zonder deze te bereiken (inzet linksboven), toch zou het over een gecontroleerde afstand in de kamer lekken, voldoende ruimte laten voor het afbuigen van de monsterstraal (onderste inzet). Krediet:microsystemen en nano-engineering, doi:10.1038/s41378-019-0072-3
Het apparaat had het extra voordeel dat het het hele proces volledig ingebakken voor elektroforetische scheiding in vrije oplossing uitvoerde, waardoor onderzoekers in een paar minuten een kwantitatieve kaart kunnen verkrijgen - veel sneller dan conventionele technieken. Het mengsel werd niet beïnvloed door het dragermedium, en de onderzoekers konden zowel zwakke als niet-covalente moleculaire interacties bestuderen.
Saar et al. ontwierp het apparaat met behulp van een native phase kwantitatieve elektroforese-eenheid die is aangesloten op een microfluïdische diffusie-apparaatafmetingseenheid (MDS). Het gecombineerde platform maakte componenten van specifieke elektroforetische mobiliteit mogelijk (µ e1 ) voor downstream-analyse op de chip, als functie van de aangelegde elektrische veldsterkte. Ze ontwierpen drie kanalen stroomafwaarts van de elektroforese-eenheid om producten van elektrolyse weg te houden van de chip zonder het apparaat binnen te gaan. Ze minimaliseerden het aantal afzonderlijke eenheden dat de stroom in het apparaat aandreef, gekoppeld aan een stabiele werking van het apparaat voor kwantitatieve monsterkarakterisering. De wetenschappers hielden de uitlaten van de elektrolyt gescheiden van het gecombineerde apparaat om elektrische potentiaal over het apparaat toe te passen zonder een elektrische kortsluiting te veroorzaken. en om de efficiënte verwijdering van elk elektrolyseproduct mogelijk te maken zonder ophoping om drukschommelingen te voorkomen.
Het onderzoeksteam paste het elektrische potentieel toe op metalen connectoren om een metalen en vloeistofinterface buiten de chip te genereren in overeenstemming met het prototype van het apparaat dat door hetzelfde team is ontworpen. In dit werk, Saar et al. ontwierp een Y-vormige stroomsplitter en hield de stromen uit elkaar totdat ze de splitter bereikten om gedeeltelijke kortsluiting te voorkomen. Ze berekenden de stroomsnelheid van de elektrolyt in het apparaat om een effect te hebben op de prestaties van het apparaat.
(a) De spanning die over de elektroforesekamer werd aangelegd, werd in lineaire stappen aangepast om specifieke fracties naar analyse te leiden. (b) De fracties werden vervolgens op maat gemaakt door beeldvorming van de diffusie-afmetingseenheid bestaande uit vier kanalen waarin de mate van diffusie van de analytmoleculen in hun omringende dragerbuffer werd gevolgd. (c) De gemiddelde grootte van de analytenmoleculen in elk van de fracties werd gevonden door de waargenomen fluorescerende profielen aan te passen voor verschillende hydrodynamische stralen (Rh) en de kleinste gemiddelde vierkante fout tussen de pasvorm (rode stippellijn) en de gegevens (blauw ononderbroken lijn). (d) De fluorescentie-intensiteit in het analysegebied varieerde afhankelijk van de concentratie van de analyten in elk van de fracties (boven) en de grootte van de componenten in een binair mengsel van lysozyme en runderserumalbumine bleek Rh = 1.9 nm te zijn. en Rh = 3,6 nm (onder). (e) Dit binaire mengsel kon niet worden gekarakteriseerd met behulp van dimensioneringstechnieken die geen prefractioneringsstappen omvatten, zoals dynamische lichtverstrooiing (DLS; lichtblauwe stippellijn). De dimensionering ervan was mogelijk met behulp van het apparaat dat in dit werk wordt beschreven (donkerblauwe doorlopende lijn). Krediet:microsystemen en nano-engineering, doi:10.1038/s41378-019-0072-3 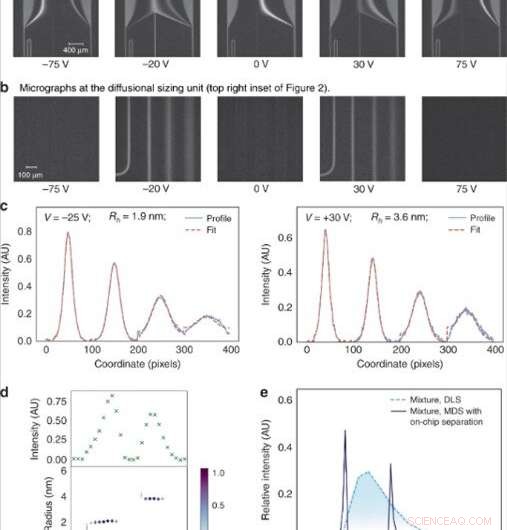
Ze beeldden het mondstuk af waarop het monster het dragermedium ontmoette als een referentiepunt voor deeltjesbeweging. De wetenschappers pasten het diffusiekanaal of de stroomsnelheid aan om de analytmoleculen nauwkeurig te bepalen, ordes van grootte groter of kleiner. Sinds ze het microfluïdische platform hebben ontworpen met behulp van Poly (dimethylsiloxaan) (PDMS), de wetenschappers elimineerden elke autofluorescentie in de opstelling voordat ze de beeldgegevens analyseerden.
Vervolgens gebruikten ze het apparaat om een binair mengsel van monstereiwitten te analyseren; runderserumalbumine en humaan lysozym. Om de oorspronkelijke toestand van de eiwitmoleculen te behouden, beeldden ze de labelvrije monsters af met een zelfgebouwde microscoop op basis van UV-golflengte en kwantificeerden ze de intrinsieke fluorescentie van het monster. Saar et al. bevestigde het vermogen om het mengsel in zijn componenten te scheiden door eerst een reeks spanningen toe te passen om de fluorescerende profielen te registreren. Vervolgens registreerden ze de elektroforetische mobiliteiten van de eiwitten (µ e1 ) gecombineerd met de stroomsnelheid in het apparaat om de meeste eiwitten en hun complexen te karakteriseren. De wetenschappers veranderden de stroomsnelheid of de aangelegde spanning om biomoleculen met diverse biofysische parameters te analyseren.
Met behulp van het platform, ze karakteriseerden snel mengsels van moleculen op nanoschaal, waar individuele analyten vergelijkbare grootten vertoonden, maar verschillende elektroforetische eigenschappen. Op basis van het resulterende histogram, het onderzoeksteam bevestigde de aanwezigheid van twee verschillende monsters. Ter vergelijking, in een off-chip conventionele scheidingsbenadering, de laatste stap vereiste fractionering door monsteroverdracht van het ene analytische hulpmiddel naar het andere via onderling verbonden buizen, de prestaties van het apparaat beperken. De totale eiwitconcentratie in het onderzoek was ongeveer 100 M en de wetenschappers hebben nauwkeurig de gevoeligheidslimiet gedetecteerd tot ongeveer 100 nM, ten opzichte van de intrinsieke fluorescentie van eiwitfracties. Voor optisch niet-actieve verbindingen, Saar et al. suggereren een alternatieve detectie- en karakteriseringsstrategie, zoals droge massa-detectie.
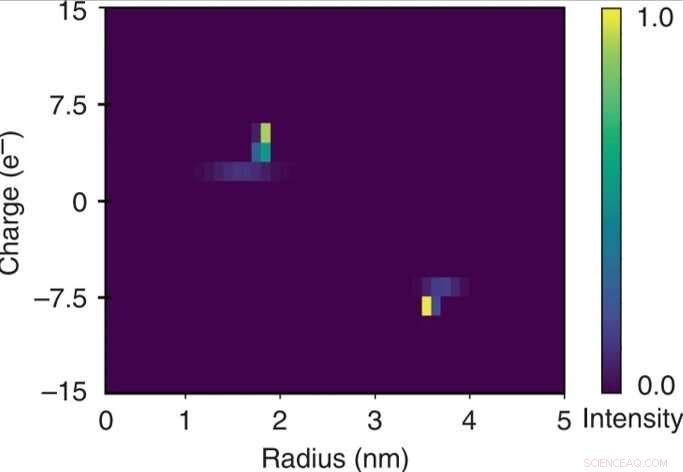
Snelle tweedimensionale karakterisering van een mengsel van runderserumalbumine en humaan lysozym. Door de kwantitatieve aard van de elektroforetische scheidingseenheid kon de aangelegde potentiaal worden gerelateerd aan de elektroforetische mobiliteit van elk van de fracties. Deze gegevens werden gebruikt in combinatie met de geëxtraheerde hydrodynamische stralen (Rh) om de effectieve ladingen (q) van de moleculen in elk van de fracties te schatten en om een tweedimensionale q vs Rh-kaart van het mengsel te construeren over een tijdschaal van enkele minuten door het apparaat alleen bij een enkel beeldvormingsframe bewaken. Krediet:microsystemen en nano-engineering, doi:10.1038/s41378-019-0072-3
Saar et al. gebruikte de strategie om als proof-of-concept tweedimensionale (2-D) karakteristieke kaarten van het eiwitmengsel te verkrijgen. Ze haalden kwantitatieve informatie uit de scheidingsstap en brachten de toegepaste potentialen in verband met de elektroforetische mobiliteiten van de soort om de werkzaamheid van het apparaat te schatten. Ze registreerden de stroom die in het systeem vloeide tijdens normaal bedrijf en wanneer de scheidingskamer werd kortgesloten om de totale elektrische weerstand van het apparaat en de elektroden te schatten.
De onderzoekers berekenden de elektroforetische mobiliteit als de beweging van een deeltje in een elektrisch veld voor elk van de fracties. Op basis van de experimentele gegevens, de geconstrueerde 2-D karakteristieke kaart omvatte de effectieve lading (q) en de hydrodynamische straal (Rh) van het mengsel. De resulterende elementaire ladingseenheden van de specifieke eiwitten kwamen overeen met geschatte waarden elders. Ze verkregen de volledige tweedimensionale kaart door slechts een enkel beeldvormingsframe te bewaken voor snelle analyse in oplossing.
De analytische tijd van het microfluïdische apparaat van scheiding tot diffusiemeting en beeldvorming was ongeveer 14 seconden. De wetenschappers construeerden de experimentele 2D-kaart met in totaal slechts 3 µL monster gedurende zeven minuten, ordes van grootte sneller dan de tijdschaal om conventionele 2D-eiwitgels uit te voeren. Het onderzoeksteam voerde een breed scala aan biomoleculaire interacties uit, in oplossing, direct onder inheemse omstandigheden die voorheen uitdagend waren om in het laboratorium te presteren.
Op deze manier, Kadi L. Saar en collega's ontwikkelden een microfluïdisch apparaat dat scheiding op de chip combineert met directe analyse op de chip om de bestaande conventionele benaderingen op microschaal te vervangen. Met behulp van het apparaat, ze analyseerden snel een binair mengsel van eiwitten die niet konden worden geïdentificeerd als individuele componenten via bestaande benaderingen van oplossingsgrootte. Ze construeerden een 2D-karakteristieke kaart van het heterogene mengsel op een snelle tijdschaal om de mogelijkheid van eiwitkarakterisering in oplossing te openen met een ongekende tijdresolutie in vergelijking met bestaande biofysische technieken.
© 2019 Wetenschap X Netwerk
 Verschil tussen natriumcarbonaat en calciumcarbonaat
Verschil tussen natriumcarbonaat en calciumcarbonaat X-ray laser sight onthult medicijndoelen
X-ray laser sight onthult medicijndoelen Comb breathalyzer is nu duizendmaal gevoeliger voor biomarkers voor ziekten
Comb breathalyzer is nu duizendmaal gevoeliger voor biomarkers voor ziekten Onderzoekers ontwikkelen biohernieuwbare, biologisch afbreekbare kunststoffen
Onderzoekers ontwikkelen biohernieuwbare, biologisch afbreekbare kunststoffen Wat zijn de beperkingen van Covalent & Metallic Roosters?
Wat zijn de beperkingen van Covalent & Metallic Roosters?
 Grass Growth Science Project
Grass Growth Science Project Overstroming van Parijs grijpt terug op een van de grote doorbraken in de hydrologie
Overstroming van Parijs grijpt terug op een van de grote doorbraken in de hydrologie Menselijke activiteit heeft het Murray-estuarium kwetsbaarder gemaakt voor droogte
Menselijke activiteit heeft het Murray-estuarium kwetsbaarder gemaakt voor droogte Hoe beïnvloeden internationale ontwikkelingsprojecten de waarde van onroerend goed?
Hoe beïnvloeden internationale ontwikkelingsprojecten de waarde van onroerend goed? Vorig jaar was het bosbrandseizoen historisch voor West, maar Idaho ontsnapte. Hoe zit het met dit jaar?
Vorig jaar was het bosbrandseizoen historisch voor West, maar Idaho ontsnapte. Hoe zit het met dit jaar?
Hoofdlijnen
- Activisten willen brug over snelweg bouwen om wilde dieren veilig over te steken
- Studie vindt verband tussen ontbossing en visserijopbrengsten in de Amazone
- Canadese kariboes, habitat blijft afnemen:rapport
- Projectideeën om het menselijke spijsverteringsstelsel te laten zien op de middelbare school voor studenten
- Wat is de vloeistof die de ruimte tussen de kern en het celmembraan vult?
- Tijgers klampen zich vast aan overleving in steeds meer gefragmenteerde bossen op Sumatras
- Bijt hierop:onderzoeker ontdekt dat alligators haaien eten
- Batesiaanse mimiek:hoe copycats zichzelf beschermen
- Een derde van alle haaiensoorten in de vinnenhandel wordt bedreigd
- Nieuwe studie stelt ongebruikelijke forensische onderzoekstechniek op de proef

- Agro-industrieel afval kan worden gebruikt als materiaal voor huisvesting en infrastructuur

- Bacteriën als levende fabrieken voor de productie van krachtige antibiotica

- Een magnetische kurk voor het verwijderen van watervervuiling

- Nieuwe printtechniek voor flexibele elektronica

 Rijke landen moeten betalen voor klimaatschade:NGO's
Rijke landen moeten betalen voor klimaatschade:NGO's Slechte dingen over verkenning van de ruimte
Slechte dingen over verkenning van de ruimte Maya oorlogszuchtiger dan eerder werd gedacht
Maya oorlogszuchtiger dan eerder werd gedacht Hoe compressieve sterkte te berekenen
Hoe compressieve sterkte te berekenen Kijken naar een medicijn in actie:precieze werking antikankermedicijnen in de cel opgehelderd
Kijken naar een medicijn in actie:precieze werking antikankermedicijnen in de cel opgehelderd Waardoor komt er een einde aan een ijstijd?
Waardoor komt er een einde aan een ijstijd? Model suggereert dat het vastleggen van CO2 in diepzeesedimenten een haalbare optie kan zijn
Model suggereert dat het vastleggen van CO2 in diepzeesedimenten een haalbare optie kan zijn Hoe zorgen fans ervoor dat je je cooler voelt?
Hoe zorgen fans ervoor dat je je cooler voelt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

