
Wetenschap
Wat is een mol die in de chemie wordt gebruikt?
Hier is een uitsplitsing:
* Definitie: Een mol wordt gedefinieerd als de hoeveelheid stof die zoveel elementaire entiteiten (atomen, moleculen, ionen, enz.) Bevat, omdat er atomen zijn in 0,012 kilogram koolstof-12.
* Avogadro's nummer: Deze definitie vertaalt zich in een mol die 6.02214076 × 10^23 elementaire entiteiten bevat, die bekend staat als het nummer van Avogadro.
* Belang: De mol vereenvoudigt berekeningen in de chemie door een consistente manier te bieden om de macroscopische eigenschappen van stoffen (zoals massa en volume) te relateren aan de microscopische wereld van atomen en moleculen.
Hier is hoe de mol wordt gebruikt:
* massa: Eén mol van een stof heeft een massa gelijk aan zijn molaire massa (de massa van één mol van die stof, uitgedrukt in gram per mol).
* Volume: Eén mol van een ideaal gas beslaat een volume van 22,4 liter bij standaardtemperatuur en druk (STP).
* reacties: Chemische vergelijkingen kunnen worden geïnterpreteerd in termen van mol, zodat u de hoeveelheden reactanten en producten kunt berekenen die bij een reactie betrokken zijn.
In wezen fungeert de mol als een brug tussen de macroscopische wereld die we kunnen observeren en de microscopische wereld van atomen en moleculen. Het is een essentieel hulpmiddel voor het begrijpen en uitvoeren van chemische berekeningen.
 Kunnen workshops over huishoudelijk watergebruik het consumentengedrag beïnvloeden?
Kunnen workshops over huishoudelijk watergebruik het consumentengedrag beïnvloeden?  Stijgende temperaturen kunnen gewasvoeding beschermen als klimaatveranderingen
Stijgende temperaturen kunnen gewasvoeding beschermen als klimaatveranderingen Wat zijn de kenmerken van een tropische storm?
Wat zijn de kenmerken van een tropische storm?  Paddy bodembemesting kan het broeikaseffect helpen verminderen
Paddy bodembemesting kan het broeikaseffect helpen verminderen Verboden pesticiden in Europese rivieren
Verboden pesticiden in Europese rivieren
Hoofdlijnen
- Waarom is het celmembraan belangrijk om een cel te overleven?
- Hoe biggensterfte bij zeugen in losloopsystemen te verminderen
- Hommels bestuderen om meer te leren over menselijke intelligentie en geheugen
- Hebben wetenschappers embryo's nodig om het stamcelonderzoek te bevorderen?
- Waarom kunnen we ons niet herinneren dat we baby's waren?
- Hoe vampiervleermuizen overleven op een dieet van bloed
- Wat is een functie van polyfenoloxidase in de biologie?
- Welk achtervoegsel staat aan het einde van veel namen voor suikers?
- Leuke wasberen zijn superleerlingen en waarschijnlijk criminele meesterbreinen uit de vuilnisbak
- Structureel bewijs voor een dynamische metallocofactor tijdens distikstofreductie door Mo-nitrogenase
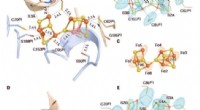
- Selectieve oplossing van elementair goud uit multimetaalbronnen in organische oplossingen

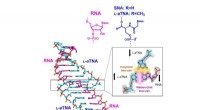
- De helix van het leven:nieuwe studie laat zien hoe RNA zich stabiel bindt aan kunstmatige nucleïnezuren
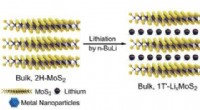
- Waterstofproductie in een besloten ruimte
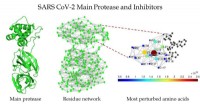
- SARS-CoV-2-enzym aanpakken met remmers
 Zuidwest-IJsland trilt - en staat op het punt om uit te barsten
Zuidwest-IJsland trilt - en staat op het punt om uit te barsten Ultrasnelle elektronen in magnetische oxiden:een nieuwe richting voor spintronica?
Ultrasnelle elektronen in magnetische oxiden:een nieuwe richting voor spintronica?  Leven we in een dystopie?
Leven we in een dystopie? Van potloodstrepen tot kwantumcomputers
Van potloodstrepen tot kwantumcomputers Australische politie jaagt op moordenaar van gigantische krokodil
Australische politie jaagt op moordenaar van gigantische krokodil Hoe noem je een zandland zonder bomen?
Hoe noem je een zandland zonder bomen?  Hoe ESP werkt
Hoe ESP werkt  Welke golven zijn niet transversaal?
Welke golven zijn niet transversaal?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

