
Wetenschap
Vormen boraxkristallen sneller dan zoutkristallen?
* kristallisatiesnelheid hangt af van vele factoren:
* Temperatuur: Warmer -oplossingen hebben de neiging om sneller te kristalliseren, maar er is een limiet.
* Oplossingsconcentratie: Een meer geconcentreerde oplossing betekent meer opgelost materiaal dat beschikbaar is om kristallen te vormen, wat mogelijk leidt tot snellere groei.
* onzuiverheden: De aanwezigheid van onzuiverheden kan de vorming van kristal verstoren.
* nucleatie -sites: De aanwezigheid van oppervlakken voor kristallen om zich te laten vormen (zoals een touw, ruw oppervlak of stofdeeltjes) kan de snelheid beïnvloeden.
* agitatie: Roeren of bewegen van de oplossing kan de kristalgroei verstoren.
* Borax vs. zout: Hoewel bekend is dat Borax kristallen gemakkelijk vormt, betekent dit niet noodzakelijkerwijs dat het altijd sneller is dan zout.
Om een definitief antwoord te krijgen, moet u ze onder gecontroleerde omstandigheden vergelijken, waardoor alle andere factoren constant blijven.
In algemene zin:
* Borax -kristallen zijn vaak groter en meer esthetisch aantrekkelijk: Dit kan suggereren dat ze met een iets langzamer tempo groeien, waardoor tijd voor grotere, meer goed gedefinieerde kristallen kan worden gevormd.
* Zoutkristallen kunnen zich snel vormen: Zout is erg oplosbaar en vormt gemakkelijk kristallen. Ze kunnen echter kleiner en minder visueel interessant zijn.
Probeer dit experiment voor een eerlijke vergelijking:
1. Bereid identieke oplossingen voor: Gebruik dezelfde hoeveelheid water en gelijke concentraties borax en zout.
2. Houd al het andere constant: Gebruik dezelfde temperatuur-, container- en agitatieniveau.
3. Let op het kristallisatieproces: Let op wanneer de eerste zichtbare kristallen verschijnen en hoe snel ze groeien.
Dit experiment geeft u een betrouwbaarder antwoord over welke kristal zich sneller vormt onder specifieke omstandigheden.
 Geestelijke gezondheid kan het volgende slachtoffer zijn van de opwarming van de aarde
Geestelijke gezondheid kan het volgende slachtoffer zijn van de opwarming van de aarde Wetenschappers onderzoeken hoe aerosoltypes wolkenvorming beïnvloeden
Wetenschappers onderzoeken hoe aerosoltypes wolkenvorming beïnvloeden Tyfoon Hagibis volgen vanuit de ruimte
Tyfoon Hagibis volgen vanuit de ruimte Studie bevestigt grote aardbevingen langs Olympic Mountain-fouten
Studie bevestigt grote aardbevingen langs Olympic Mountain-fouten COVID-19-lockdowns hebben een aanzienlijke impact op de wereldwijde luchtkwaliteit
COVID-19-lockdowns hebben een aanzienlijke impact op de wereldwijde luchtkwaliteit
Hoofdlijnen
- Wat zijn de verschillen tussen een plant en een dierlijke cel onder een microscoop?
- Hoe reguleert de autofagische route de lage stikstoftolerantie in tomaat?
- Hoe heten oceanen?
- Onder de motorkap:hoe omgeving en genomen op elkaar inwerken bij de ontwikkeling van planten
- Waarom is DNA het zwakste bewijs van evolutie?
- Onderzoek laat zien hoe vistuig een langzame dood van walvissen kan veroorzaken
- Nieuwe hypothese legt uit hoe menselijke voorouders vuur in hun voordeel gebruikten
- Hoe CFU uit verdunning te berekenen
- Kan een naaimachine DNA aan elkaar naaien?
- Stokken en stenen kunnen je botten breken, maar deze reactie bewerkt skeletten

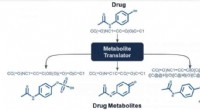
- Deep learning geeft medicijnontwerp een boost
- Nanocilindervibraties helpen bij het kwantificeren van polymeeruitharding voor 3D-printen
- Cyborg-technologie kan nieuwe diagnostiek mogelijk maken, samensmelting van mens en AI
- Een op de vijf artikelen over materiaalchemie kan het mis hebben, studie suggereert:

 Waarom kan het oppervlak van het plasmamembraan worden beschreven als een mozaïek?
Waarom kan het oppervlak van het plasmamembraan worden beschreven als een mozaïek?  Waarom lijken zonnevlekken donker?
Waarom lijken zonnevlekken donker?  Verrassende feiten en overtuigingen over eclipsen uit de middeleeuwen en de renaissance
Verrassende feiten en overtuigingen over eclipsen uit de middeleeuwen en de renaissance  Maar liefst een op de acht (13%) Poolse ouders heeft misschien spijt van het krijgen van kinderen
Maar liefst een op de acht (13%) Poolse ouders heeft misschien spijt van het krijgen van kinderen Welke staten zijn op 25N Latitude?
Welke staten zijn op 25N Latitude?  Hoe ver is Orion naar de zon?
Hoe ver is Orion naar de zon?  Welke organismen voeren fotosynthese uit?
Welke organismen voeren fotosynthese uit?  Nieuw record in loodvrije halide dubbele perovskieten
Nieuw record in loodvrije halide dubbele perovskieten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

