
Wetenschap
Waarom worden NaCl en MGCL2 beide als zuur getoond met verschillende indicatoren, maar ze eigenlijk neutraal?
* Hydrolyse: Hoewel NaCl en Mgcl₂ zelf neutraal zijn, kunnen hun ionen hydrolyse in water ondergaan. Dit betekent dat de ionen reageren met water om een enigszins zure of basisoplossing te vormen.
* NaCl: Het natriumion (Na⁺) hydrolyseert niet aanzienlijk. Het chloride -ion (CL⁻) kan een lichte hydrolyse ondergaan, waardoor een zeer kleine hoeveelheid hydroxide -ionen (OH⁻) wordt geproduceerd en de oplossing *zeer enigszins basic *maakt *. Dit effect is echter zo klein dat het als verwaarloosbaar wordt beschouwd.
* mgcl₂: Het magnesiumion (mg²⁺) is meer vatbaar voor hydrolyse dan het natriumion. Het reageert met water om een kleine hoeveelheid hydroniumionen (H₃o⁺) te produceren, waardoor de oplossing *enigszins zuur *is.
* indicatoren: Indicatoren zijn stoffen die van kleur veranderen, afhankelijk van de pH van de oplossing. Als een indicator wordt gebruikt om een oplossing van NaCl of MGCL₂ te testen, kan dit een lichte kleurverandering vertonen, wat een lichte zuurgraad of basiciteit suggereert. Deze verandering valt echter vaak binnen de foutenmarge voor de indicator en is mogelijk geen echte weerspiegeling van de werkelijke pH van de oplossing.
Samenvattend:
* NaCl en Mgcl₂ zijn beide neutrale zouten.
* Hun ionen kunnen een lichte hydrolyse ondergaan, wat leidt tot een zeer kleine verandering in pH.
* indicatoren kunnen een lichte kleurverandering vertonen als gevolg van hydrolyse, maar dit betekent niet noodzakelijkerwijs dat de oplossing zuur of basic is.
Het is belangrijk om te onthouden dat de term "neutraal" in chemie vaak wordt gebruikt ten opzichte van een specifiek pH -bereik. Hoewel NaCl en Mgcl₂ voor de meeste praktische doeleinden als neutraal worden beschouwd, kunnen ze een lichte afwijking vertonen van een perfect neutrale pH vanwege de subtiele effecten van hydrolyse.
 Hoeveel neutronen in zwavel?
Hoeveel neutronen in zwavel?  Nieuwe sonde ontwikkeld om een gemeenschappelijk doelwit voor ontstekingsremmende medicijnen te detecteren
Nieuwe sonde ontwikkeld om een gemeenschappelijk doelwit voor ontstekingsremmende medicijnen te detecteren Is lithiumhydride een covalente binding?
Is lithiumhydride een covalente binding?  Welke regel wordt gebruikt bij het schrijven van het chemische symbool van en element?
Welke regel wordt gebruikt bij het schrijven van het chemische symbool van en element?  Wat is de reactie van zwavelzuur met lithiumhydroxide?
Wat is de reactie van zwavelzuur met lithiumhydroxide?
 Brengt de opkomst van het ecotoerisme wilde dieren in een nieuw soort gevaar?
Brengt de opkomst van het ecotoerisme wilde dieren in een nieuw soort gevaar?  Onderdelen van de waterkoeler kunnen een bron zijn van blootstelling aan organofosfaatesters
Onderdelen van de waterkoeler kunnen een bron zijn van blootstelling aan organofosfaatesters Sigarettenpeuken vormen een groot gevaar voor microplastics in de oceanen
Sigarettenpeuken vormen een groot gevaar voor microplastics in de oceanen Wat maakt dat een Airbnb-host betrouwbaar lijkt voor potentiële huurders?
Wat maakt dat een Airbnb-host betrouwbaar lijkt voor potentiële huurders?  Iraks Tuin van Eden nu als een woestijn
Iraks Tuin van Eden nu als een woestijn
Hoofdlijnen
- Disruptieve bio-engineering - verandert de manier waarop cellen met elkaar omgaan
- Welke stof die wordt gevonden tussen het celmembraan en de kern die voornamelijk uit water bestaat, bevat organellen?
- In welk vlak komt pronatie en supinatie van de onderarm voor?
- Hoe wordt de kern van een cel gescheiden van het cytoplasma?
- Wat doet ribosomen ermee overgebleven of afval?
- Hoe weet je waar een vis naartoe gaat? Wetenschappers pakken gaten in de trackinggegevens van zeedieren aan
- Jeugddieet kan bijdragen aan aangetaste verstandskiezen, blijkt uit onderzoek
- Hoe een team van biologen een plaag aanpakt en soorten voor uitsterven behoedt
- Wat eerst kwam,
- Je volgende houten stoel kan plat aankomen en dan drogen in een 3D-vorm

- Molecuul groene thee kan hartaanvallen voorkomen

- Schimmel Rode Zee levert aanknopingspunten voor nieuwe medicijnen tegen epilepsie
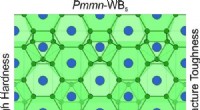
- Wetenschappers voorspellen een nieuw superhard materiaal met unieke eigenschappen
- Onderzoek vindt ernstige problemen met forensische software

 Waarom is een koolstof-dubbele binding niet twee keer zo sterk enkelvoudige binding?
Waarom is een koolstof-dubbele binding niet twee keer zo sterk enkelvoudige binding?  Spookachtige waarnemingen in kristal wijzen op uiterst zeldzame kwantumspinvloeistof
Spookachtige waarnemingen in kristal wijzen op uiterst zeldzame kwantumspinvloeistof Nieuwe vloeibare kristallen geproduceerd door het stapelen van anti-aromatische eenheden zouden kunnen leiden tot vooruitgang op het gebied van organische halfgeleiders
Nieuwe vloeibare kristallen geproduceerd door het stapelen van anti-aromatische eenheden zouden kunnen leiden tot vooruitgang op het gebied van organische halfgeleiders  Een onderzoekstoolbox werpt licht op sociale identiteitsveranderingen in Europa
Een onderzoekstoolbox werpt licht op sociale identiteitsveranderingen in Europa Een pleidooi voor wiskundeleraren:laten we pi irrationeel houden
Een pleidooi voor wiskundeleraren:laten we pi irrationeel houden Welke wetenschappelijke theorie zegt dat alle levende wezens bestaan uit cellen als levensfuncties en nieuwe cellen produceren?
Welke wetenschappelijke theorie zegt dat alle levende wezens bestaan uit cellen als levensfuncties en nieuwe cellen produceren?  Hoe vind je de dichtheid van twee onbekende vloeistoffen?
Hoe vind je de dichtheid van twee onbekende vloeistoffen?  Geven twee batterijen van 12 volt 100 Amp uur me 200 uur bij 24 volt?
Geven twee batterijen van 12 volt 100 Amp uur me 200 uur bij 24 volt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

