
Wetenschap
Waarom is een koolstof-dubbele binding niet twee keer zo sterk enkelvoudige binding?
In het geval van een dubbele koolstof-koolstofbinding zijn er twee elektronenparen gedeeld tussen de koolstofatomen. Dit is meer dan het enkele paar elektronen dat in een enkele binding wordt gedeeld, maar het is niet het dubbele. Bovendien is de elektronegativiteit van koolstof relatief laag, wat betekent dat de elektronen door geen van beide atomen erg sterk worden vastgehouden. Ten slotte is de bindingslengte van een dubbele binding korter dan die van een enkele binding, wat betekent dat de elektronen dichter bij elkaar worden gehouden.
Al deze factoren dragen ertoe bij dat een dubbele koolstof-koolstofbinding niet twee keer zo sterk is als een enkele binding. In werkelijkheid is het slechts ongeveer 1,5 keer sterker.
 Studie bevestigt gestage opwarming van oceanen in de afgelopen 75 jaar
Studie bevestigt gestage opwarming van oceanen in de afgelopen 75 jaar Suomi NPP ziet tropische depressie Haikui vorm
Suomi NPP ziet tropische depressie Haikui vorm Wereldbank spoort steden aan om te investeren in nieuwe infrastructuur om zich aan te passen aan klimaatverandering
Wereldbank spoort steden aan om te investeren in nieuwe infrastructuur om zich aan te passen aan klimaatverandering Komt natuurlijk? Wandelende wandelende takken gebruiken om natuurlijke selectie en voorspelbaarheid van evolutie te bestuderen
Komt natuurlijk? Wandelende wandelende takken gebruiken om natuurlijke selectie en voorspelbaarheid van evolutie te bestuderen  Microbenjacht onder Antarctische ijskap
Microbenjacht onder Antarctische ijskap
Hoofdlijnen
- Lijst van de toepassingen van elektroforese
- Onderzoek onthult waarom vleermuizen uitblinken als virale reservoirs zonder ziek te worden
- Differentiëren van RNA- en DNA-virussen
- Wat gebeurt er met DNA als gevolg van mutatie?
- Stamboom van Homo Sapiens blijft evolueren
- Een natuurlijke schimmelstam kan olielekkages opruimen en de oliezanden van Albertas weer tot leven brengen
- Nieuwe aanwijzingen over hoe bacteriën antibiotica ontwijken
- Hoe zal de aarde er over 50 uitzien,
- Hoe cellen zichzelf meten
- Apparaat verbindt metaal en plastic binnen enkele seconden

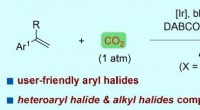
- Door zichtbaar licht aangedreven arylcarboxylering van styrenen met kooldioxide en arylhalogeniden
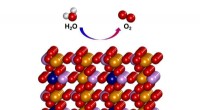
- Elektrokatalysator vertoont uitstekende watersplitsingsactiviteit
- Schorpioenen maken een fluorescerende stof die hen kan helpen beschermen tegen parasieten

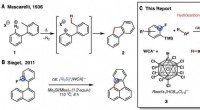
- Functionaliseren van niet-geactiveerde alkanen met behulp van reacties op basis van katalysatoren gemaakt van meer overvloedige materialen
 Wat is de structuur van een erytrocyt?
Wat is de structuur van een erytrocyt?  Grafeen kan een aan-uitschakelaar krijgen, halfgeleider toevoegen aan lange lijst met materiaalprestaties
Grafeen kan een aan-uitschakelaar krijgen, halfgeleider toevoegen aan lange lijst met materiaalprestaties Spookachtige röntgenfoto's kunnen belangrijke informatie opleveren voor het analyseren van röntgenlaserexperimenten
Spookachtige röntgenfoto's kunnen belangrijke informatie opleveren voor het analyseren van röntgenlaserexperimenten Computerstoringen verstoren de lessen als scholen weer online zijn
Computerstoringen verstoren de lessen als scholen weer online zijn Protonen gebruiken om tussenlaagkrachten in van der Waals-materialen af te stemmen
Protonen gebruiken om tussenlaagkrachten in van der Waals-materialen af te stemmen Welke verandering vindt er plaats bij het atoom als het licht uitzendt?
Welke verandering vindt er plaats bij het atoom als het licht uitzendt?  Wetenschappers hebben voor het eerst excitonen in nikkeloxide gevonden
Wetenschappers hebben voor het eerst excitonen in nikkeloxide gevonden Schakelbare DNA-minimachines slaan informatie op
Schakelbare DNA-minimachines slaan informatie op
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

