
Wetenschap
Zou je me de volledige lijst met kationen en anionen laten zien?
* Groot getal: Er zijn talloze mogelijke combinaties van elementen en hun kosten.
* Nieuwe ontdekkingen: Chemici ontdekken constant nieuwe elementen en verbindingen.
* Contextafhankelijkheid: De lading van een ion kan variëren, afhankelijk van de chemische omgeving.
Ik kan u echter een uitgebreide lijst met gemeenschappelijke kationen en anionen geven , die u als uitgangspunt kunt gebruiken:
Gemeenschappelijke kationen:
* Groep 1 (Alkali metalen): Li⁺, na⁺, k⁺, rb⁺, cs⁺
* Groep 2 (Alkaline Earth Metals): Be²⁺, mg²⁺, ca²⁺, sr²⁺, ba²⁺
* overgangsmetalen: Fe²⁺, Fe³⁺, cu⁺, cu²⁺, zn²⁺, ni²⁺, co²⁺, cr³⁺, mn²⁺, ag⁺, au⁺, au³⁺, pt²⁺, hg²⁺, cd²⁺
* Andere veel voorkomende kationen: Al³⁺, nh₄⁺, h⁺, pb²⁺, sn²⁺, sn⁴⁺, bi³⁺, tl⁺, tl³⁺, ti⁴⁺, v⁴⁺, cr²⁺, mn³⁺, mn⁴⁺, co³⁺
Gemeenschappelijke anionen:
* Groep 17 (halogenen): F⁻, cl⁻, br⁻, i⁻
* Andere veel voorkomende anionen: O²⁻, s²⁻, n³⁻, p³⁻, no₃⁻, co₃²⁻, so₄²⁻, po₄³⁻, oh⁻, cn⁻, clo⁻, clo₂⁻, clo₃⁻, clo₄⁻, mno₄⁻, cro₄²⁻, cr₂o₇²⁻
belangrijke opmerkingen:
* Polyatomische ionen: Merk op dat veel van de anionen in de lijst polyatomisch zijn, wat betekent dat ze uit twee of meer atomen bestaan.
* laadvariabiliteit: De lading van sommige ionen kan variëren, afhankelijk van de verbinding waar ze deel van uitmaken. IJzer kan bijvoorbeeld een +2 of +3 lading hebben, afhankelijk van de verbinding.
Verdere verkenning:
* Periodieke tabel: Het periodiek systeem is een geweldig hulpmiddel om de kosten van ionen te begrijpen. Elementen in dezelfde groep hebben meestal vergelijkbare kosten.
* Chemische leerboeken: Chemie -schoolboeken bieden gedetailleerde informatie over de kosten van verschillende ionen en hun eigenschappen.
* online bronnen: Websites zoals Chemicool en Pubchem bieden uitgebreide lijsten met ionen en hun eigenschappen.
Vergeet niet dat deze lijst niet uitputtend is. Om de specifieke kosten van ionen in verschillende verbindingen te begrijpen, moet u betrouwbare middelen raadplegen en de basisregels van chemische binding leren.
 Wat zijn de krachten van elk doel op een samengestelde microscoop?
Wat zijn de krachten van elk doel op een samengestelde microscoop?  Als warmte uit laurinezuur wordt verwijderd, zal het dan vast worden?
Als warmte uit laurinezuur wordt verwijderd, zal het dan vast worden?  Thorium-aluminiumcomplex het eerste met een actinide-element dat elektronen afstaat bij binding met een metaal
Thorium-aluminiumcomplex het eerste met een actinide-element dat elektronen afstaat bij binding met een metaal Een molecuul met licht negatieve en positieve uiteinden met betrekking tot verandering?
Een molecuul met licht negatieve en positieve uiteinden met betrekking tot verandering?  Microbezorgservice voor meststoffen
Microbezorgservice voor meststoffen
 EPA maakt Californische voorgestelde verbod op nieuwe gasauto's belachelijk
EPA maakt Californische voorgestelde verbod op nieuwe gasauto's belachelijk Nabijheid van land bepaalt hoe koraalrifgemeenschappen reageren op klimaatveranderingen
Nabijheid van land bepaalt hoe koraalrifgemeenschappen reageren op klimaatveranderingen Welke roofdieren eten het wandelstokinsect?
Welke roofdieren eten het wandelstokinsect?  Uit onderzoek blijkt dat Noord-Atlantische oscillatie de reproductie van bomen in heel Europa synchroniseert
Uit onderzoek blijkt dat Noord-Atlantische oscillatie de reproductie van bomen in heel Europa synchroniseert Eerste wereldwijde pact ter ondersteuning van inheemse landrechten gelanceerd
Eerste wereldwijde pact ter ondersteuning van inheemse landrechten gelanceerd
Hoofdlijnen
- De plaats voor ribosomale RNA -synthese is de?
- Wat zijn de purine basen van DNA?
- Wat is assimilatie in de biologie?
- Hoe extremofielen werken
- Wat de kleinste infectieuze agentia onthullen over evolutie
- Reconstructies laten zien hoe enkele van de vroegste dieren leefden en stierven (met video)
- Indonesië's selfiesnagende aap uitgeroepen tot Persoon van het Jaar
- Wat kunnen wetenschappers leren van wormen die gloeien in het donker? De geheimen van regeneratie om te beginnen
- Wat wandelen door de interstitiële vloeistof die de bacteriën en virus geïnfecteerde cellen die ze tegenkomen, die herkennen?
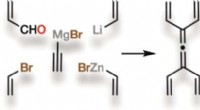
- Gespannen, symmetrisch, en nieuw:tetravinylalleen, een klein maar krachtig molecuul, is voor het eerst gesynthetiseerd
- Studie innoveert in glutenvrije formuleringen, smakelijker en voedzamer brood creëren

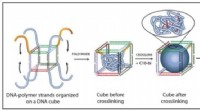
- DNA-strengen gebruiken om nieuwe polymeermaterialen te ontwerpen
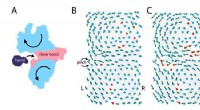
- Op ijzer gebaseerde katalysatoren ontdekt in door licht aangedreven kooldioxidehydrogenering

- Hoe een functionele moleculaire machine te coderen?
 Het pad van chemicaliën door de bodem volgen
Het pad van chemicaliën door de bodem volgen Dawns nieuwste baan onthult dramatische nieuwe beelden van Occator-krater
Dawns nieuwste baan onthult dramatische nieuwe beelden van Occator-krater Is helium een element of molicles?
Is helium een element of molicles?  Door luminescentie schakelbare koolstofnanodots volgen intracellulaire handel en medicijnafgifte
Door luminescentie schakelbare koolstofnanodots volgen intracellulaire handel en medicijnafgifte UCI, NASA onthult nieuwe details over ijsverlies in Groenland
UCI, NASA onthult nieuwe details over ijsverlies in Groenland SAT Math Prep: Lineaire vergelijkingen oplossen
SAT Math Prep: Lineaire vergelijkingen oplossen orkanen, overstromingsverzekering en de gevaren van business as usual
orkanen, overstromingsverzekering en de gevaren van business as usual Verloren stad gebruikte 500 jaar bodemerosie ten voordele van de akkerbouw
Verloren stad gebruikte 500 jaar bodemerosie ten voordele van de akkerbouw
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

