
Wetenschap
Hoe een functionele moleculaire machine te coderen?
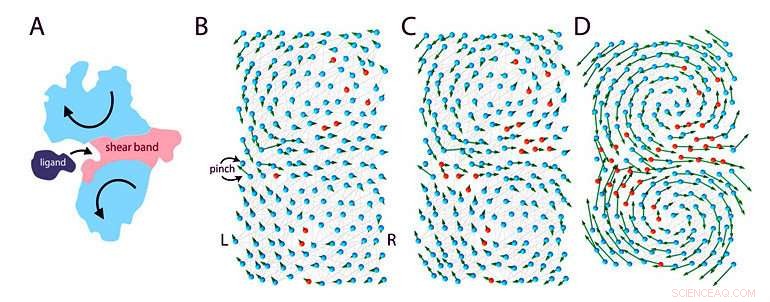
Figuur 1:elastisch model van een eiwit dat aan een ligand bindt. (A) Wanneer een eiwit aan een ligand bindt, het ondergaat grootschalige bewegingen (pijlen) die de handtekeningen zijn van buigende functionele eiwitten. Dit is alleen mogelijk dankzij de aanwezigheid van bepaalde "floppy" regio's (roze "shear band") over het eiwit die de stijve (blauwe) regio's van het eiwit in twee domeinen scheiden. (B)-(D) Het team modelleerde een eiwit van 200 aminozuren tijdens verschillende stadia van evolutie:het overgaan van een niet-functionele (B) naar een functionele (D) toestand. Het eiwit is gemodelleerd als een elastisch veernetwerk met twee soorten aminozuren, gemodelleerd als kralen:roze aminozuren zijn flexibel en blauwe aminozuren zijn rigide. De onderzoekers bootsen evolutie na door één willekeurig aminozuur per keer (mutatie) van roze naar blauw te veranderen. aanvankelijk, het eiwit is meestal rigide en niet-functioneel. Tijdens de evolutie, flexibele aminozuren worden toegevoegd, wat handig, sommige niet. Overuren, een "floppy" gebied vormt zich in het midden van het molecuul, waardoor het eiwit flexibeler wordt om te buigen en aan het ligand te binden. Het model schatte dat na duizend mutaties een efficiënte oplossing wordt bereikt. Krediet:Instituut voor Basiswetenschappen
Een internationaal team heeft een model ontwikkeld dat eiwitevolutie simuleert. beginnend met stijf, onfunctionele eiwitten, het computermodel laat zien hoe evoluerende eiwitcomponenten kunnen samenwerken om dynamische en efficiënte moleculaire machines te creëren. Dankzij flexibiliteit kunnen eiwitten hun 3D-conformatie veranderen om andere moleculen te binden:deze eigenschap is cruciaal voor hun functie. Prof. Tsvi Tlusty en Dr. Sandipan Dutta bij het Centrum voor Zachte en Levende Materie, binnen het Instituut voor Basiswetenschappen (IBS, Zuid-Korea), in samenwerking met Prof. Albert Libchaber van de Rockefeller University en Prof. Jean-Pierre Eckmann van de Universiteit van Genève hebben ze genevolutie nagebootst om eiwitten te verkrijgen die kunnen buigen en binden aan andere moleculen. Het begrijpen van deze relatie is een van de meest gewilde aspecten van eiwitbiologie; het zou kunnen helpen bij het verklaren van de farmaceutische werking van geneesmiddelen die aan hun doelwitten binden.
Evolutie heeft de levende wereld die we om ons heen zien gedurende miljarden jaren gevormd. Ontelbare eiwitten werken harmonieus samen om deze levensprocessen gaande te houden. Ze zijn verantwoordelijk voor de goede werking van elk organisme:ze herkennen andere moleculen (liganden), binden en converteren. Anderen hebben een transportfunctie, structuur bieden, en ondersteuning van de cellen. Genen slaan de informatie op over de productie en het ontwerp van deze moleculaire machines. Echter, ondanks tientallen jaren van onderzoek, het opstellen van de "kaart" die het pad van genen naar eiwitfunctie tekent, is niet triviaal.
Volgens een recente hypothese, eiwitfunctie is afhankelijk van "flexibele gewrichten". Deze studie, gepubliceerd in Proceedings van de National Academy of Sciences ( PNAS ), onderzoekt het verband tussen functie en flexibiliteit door eiwitten zoals elastische netwerken te modelleren. Bij dit model is eiwitten zijn gemaakt van flexibele (polaire) en stijve (hydrofobe) aminozuren die verbonden zijn door moleculaire "veren". Als sommige delen van het eiwit flexibel genoeg zijn, ze vormen een "floppy" kanaal, en de hele moleculaire machine kan buigen als een scharnier. Door deze beweging kunnen ze zich effectief binden aan andere moleculen. De binding tussen een ligand en een stijf of flexibel eiwit kan worden gezien als een bal die op een rots of een zacht kussen landt. De bal stuitert waarschijnlijk weg nadat hij de rots heeft geraakt, maar het kussen zal het eerder accepteren. Daarom, het flexibele eiwit is een beter bindmiddel.
Bij dit model is genen slaan de details van het eiwitontwerp op een binaire manier op:flexibele aminozuren worden opgeslagen als nullen en rigide aminozuren als enen. Als resultaat, de gehele eiwitstructuur kan worden vereenvoudigd als een code, zoals 11110001...111, vergelijkbaar met het digitale geheugen van een computer. Echter, niet alle codes leiden tot functionele eiwitten, bijvoorbeeld een code met alleen enen:111111…1111, zou leiden tot een geheel stijf eiwit, niet kunnen bewegen, en niet-functioneel. Van alle mogelijke codes, slechts enkele produceren een functioneel eiwit met een "floppy" gebied in het midden dat het ligand kan verwelkomen.
Het model bootst evolutie na door één willekeurig aminozuur per keer te veranderen. Tijdens de evolutie, de nullen en enen in het gen worden willekeurig omgedraaid door een proces dat mutatie wordt genoemd. De meeste mutaties brengen geen verschil, of leiden tot niet-functionele eiwitten, maar sommige zeldzame mutaties kunnen aanleiding geven tot een efficiënter eiwit. Eigenlijk, zowel functionele als niet-functionele eiwitten worden geproduceerd tijdens de evolutie, maar volgens Darwins theorie van "survival of the fittest", alleen de functionele eiwitten blijven behouden en de niet-functionele eiwitten sterven uiteindelijk uit.
Hoe ziet een "functionele" code eruit? Het antwoord is niet eenduidig. In feite, het aantal codes van een functioneel eiwit, zelfs een eenvoudig eiwit, is enorm, groter dan de grootte van het heelal. Echter, met behulp van technieken van data-analyse, het is mogelijk om te zoeken naar verborgen patronen in alle functionele codes om te zoeken naar enkele verenigende kenmerken. Bijvoorbeeld, het "floppy" kanaal in het eiwit heeft interessante en eigenaardige kenmerken, en een mutatie aan het ene uiteinde van het kanaal heeft langetermijneffecten die het behoud van mutaties van andere verre aminozuren sterk kunnen beïnvloeden.
"In de toekomst, we zijn van plan om te onderzoeken hoe we deze studie kunnen toepassen op echte eiwitten, zoals kinasen, " zei Groepsleider Tsvi Tlusty, een correspondent in het onderzoek. "Bovendien, de studie opent wegen om de evolutie van andere eiwitfuncties te onderzoeken, zoals moleculaire herkenning. Met behulp van enorme databases, die zijn ontwikkeld door jarenlang onderzoek, kan waarschijnlijk enkele onderliggende fenomenen over de evolutie van eiwitten blootleggen."
Hoofdlijnen
- Hoe raden werkt
- What Is Crossing Over in Genetics?
- Welke moleculen kunnen er zonder hulp door het plasmamembraan passeren?
- Vroegtijdige waarschuwing gezondheids- en welzijnssysteem kan boeren miljoenen ponden besparen
- Masterchef-techniek blijkt levensreddend te zijn voor bedreigde zeeschildpadeieren
- Biochemistry Blotting Techniques
- Hoe de hormonen van de hypofyse te onthouden
- Onderzoek suggereert dat gevaarlijke gewassenschimmel giftige chemicaliën produceert om insecten af te weren
- Welk deel van het Nephron is verantwoordelijk voor de reabsorptie van water?
- Haat-liefdeverhouding tussen oplosmiddel en water leidt tot een betere afbraak van biomassa

- Wetenschappers ontdekken fijne kneepjes van serotoninereceptor die cruciaal zijn voor betere therapieën
- Laatste onbekende structuur van HIV-1 opgelost, weer een stap in de strijd tegen het aids-virus
- Met een meerlagige aanpak, een filter om te voldoen aan de behoeften van de zoetwatervoorziening

- Nieuwe composietmaterialen verlengen de levensduur van reserveonderdelen voor apparatuur en voertuigen

 Open gerefereerde paper onthult hoe onstabiele radioactieve kernen dubbele eigenschappen kunnen worden bestudeerd
Open gerefereerde paper onthult hoe onstabiele radioactieve kernen dubbele eigenschappen kunnen worden bestudeerd Uit hoeveel atomen bestaat een persoon?
Uit hoeveel atomen bestaat een persoon?  Wat is het gas dat wordt gebruikt in neonreclames met een paarse kleur?
Wat is het gas dat wordt gebruikt in neonreclames met een paarse kleur?  Hoe vergelijkingen te factureren
Hoe vergelijkingen te factureren  Wetenschappers maken supergevoelige nanomaterialen voor DNA-diagnostiek en gerichte medicijnafgifte
Wetenschappers maken supergevoelige nanomaterialen voor DNA-diagnostiek en gerichte medicijnafgifte Skyrmions houden van hot:spinstructuren zijn zelfs bij hoge temperaturen controleerbaar
Skyrmions houden van hot:spinstructuren zijn zelfs bij hoge temperaturen controleerbaar Methode voor het bepalen van eigenschappen van elektronenstralen kan toekomstige ultraviolette, X-ray synchrotron lichtbronnen
Methode voor het bepalen van eigenschappen van elektronenstralen kan toekomstige ultraviolette, X-ray synchrotron lichtbronnen Wetenschappers ontwerpen slim asfalt met magnetische materialen voor veiligere elektrische scooters
Wetenschappers ontwerpen slim asfalt met magnetische materialen voor veiligere elektrische scooters
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com


