
Wetenschap
Waarom kookpunt afnemen met de toename van de hoogte?
* kookpunt: De temperatuur waarbij de dampdruk van een vloeistof gelijk is aan de omringende atmosferische druk, waardoor de vloeistof in een gas verandert.
* Atmosferische druk: Het gewicht van de lucht boven een bepaalde locatie.
Hoe het werkt:
1. Luchtdruk en hoogte: Naarmate je hoger in hoogte gaat, is er minder lucht boven je, wat leidt tot een afname van de atmosferische druk.
2. Dampdruk: De druk uitgeoefend door de damp van een vloeistof boven het oppervlak. Deze druk neemt toe naarmate de vloeistof opwarmt.
3. evenwicht: Op het kookpunt is de dampdruk van de vloeistof gelijk aan de atmosferische druk.
4. Lagere druk, lager kookpunt: Aangezien de atmosferische druk op grotere hoogten lager is, heeft de vloeistof minder dampdruk nodig om evenwicht te bereiken. Dit betekent dat de vloeistof op een lagere temperatuur kookt.
Voorbeeld:
Water kookt op 100 ° C (212 ° F) op zeeniveau, waar de atmosferische druk ongeveer 1 atmosfeer is (ATM). Op een hogere hoogte zoals Mount Everest is de atmosferische druk echter veel lager en kookt water op ongeveer 68 ° C (154 ° F).
Belangrijke opmerking: Deze afname van het kookpunt is significant voor het koken op hogere hoogten, omdat voedsel langer duurt om te koken vanwege de lagere kooktemperatuur van water.
 Een neutraal atoom heeft atoomnummer 12 en massa 24. Hoeveel elektronen bevat het?
Een neutraal atoom heeft atoomnummer 12 en massa 24. Hoeveel elektronen bevat het?  Eenvoudige vergelijking leidt tot het creëren van schone-energiekatalysatoren
Eenvoudige vergelijking leidt tot het creëren van schone-energiekatalysatoren Wetenschappers gebruiken RFID-chips om biologische monsters te volgen
Wetenschappers gebruiken RFID-chips om biologische monsters te volgen Wat is noch container?
Wat is noch container?  Welk systeem wordt gebruikt om valentie-elektronen rond het chemische symbool van een element weer te geven?
Welk systeem wordt gebruikt om valentie-elektronen rond het chemische symbool van een element weer te geven?
 Wetenschappers gooien reddingslijn naar 's werelds zeldzaamste primaat
Wetenschappers gooien reddingslijn naar 's werelds zeldzaamste primaat Waar haalt het zuidwesten al zijn water vandaan?
Waar haalt het zuidwesten al zijn water vandaan? Wetenschappers combineren Twitter- en satellietbeelden om de epische impact te begrijpen
Wetenschappers combineren Twitter- en satellietbeelden om de epische impact te begrijpen The Common Snakes of Oklahoma
The Common Snakes of Oklahoma  Flickr-studie geeft een momentopname van de waarde van koraalriffen
Flickr-studie geeft een momentopname van de waarde van koraalriffen
Hoofdlijnen
- Wat is het oudste celtype?
- Hoe de vlieg vliegt:Wetenschappers ontdekken een genschakelaar die verantwoordelijk is voor de vorming van vliegspieren
- Hoe schimmels de mondiale plantenkolonisatie beïnvloeden
- Hoe symbiotische bacteriën zich aanpassen aan grote veranderingen in het milieu
- Hoe verschilt cauka's van primair?
- Wat onderscheidt mensen van chimpansees en andere apen?
- Wat zijn twee voorbeelden van reacties Organismen weergeven om de homeostase te onderhouden?
- Heeft racisme Jackie Robinson gedood?
- Onderzoeker zegt:No-till-praktijken laten uitgebreide voordelen zien voor tarwe en veevoer
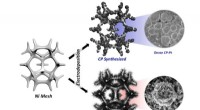
- Een snelwegtunnel maken voor ionen

- Technologieën om te extraheren, het zuiveren van kritische zeldzame aardmetalen kan een game changer zijn
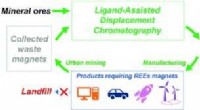
- Een concrete stap in de richting van nul CO2-uitstoot bij de cementproductie

- Groene waterstof produceren door blootstelling van nanomaterialen aan zonlicht

- Nieuwe techniek zet ammoniak naadloos om in groene waterstof
 ROBE Array kan kleine bedrijven toegang geven tot populaire vormen van AI
ROBE Array kan kleine bedrijven toegang geven tot populaire vormen van AI Waarom zijn knoppen aan het einde van een tak?
Waarom zijn knoppen aan het einde van een tak?  Wat is de term voor het maximale aantal individuen dat een ecosysteem kan ondersteunen?
Wat is de term voor het maximale aantal individuen dat een ecosysteem kan ondersteunen?  Marskrater herinnert aan Apollo-maanwandeling
Marskrater herinnert aan Apollo-maanwandeling Nieuwe niet-inheemse soorten duiken op in Grote Meren na een grotendeels schoon decennium
Nieuwe niet-inheemse soorten duiken op in Grote Meren na een grotendeels schoon decennium Wat zijn de zes menselijke zintuigen?
Wat zijn de zes menselijke zintuigen?  Onderzoekers ontdekken waarom goud naast arseen geconcentreerd is
Onderzoekers ontdekken waarom goud naast arseen geconcentreerd is  Op zoek naar een goede non-profit CEO? Kies een teddybeer, geen haai, zegt onderzoek
Op zoek naar een goede non-profit CEO? Kies een teddybeer, geen haai, zegt onderzoek
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

