
Wetenschap
Hoe kan herkristallisatie een mengsel scheiden?
Het principe:
Herkristallisatie is gebaseerd op het verschil in oplosbaarheid van de gewenste verbinding en onzuiverheden in een gekozen oplosmiddel. Het basisidee is:
* Oplosbaarheid: De meeste vaste stoffen lossen gemakkelijker op bij hogere temperaturen.
* kristallisatie: Naarmate de oplossing afkoelt, neemt de oplosbaarheid van de gewenste verbinding af, waardoor deze uit de oplossing kristalliseert, waardoor onzuiverheden achterblijven.
Het proces:
1. Oplost: Het onzuivere vaste mengsel wordt opgelost in een heet oplosmiddel (meestal de minimale hoeveelheid die nodig is voor volledige oplossing). De keuze van het oplosmiddel is cruciaal - het zou moeten:
* Los de gewenste verbinding goed op als hij heet is.
* Los onzuiverheden slecht op, of helemaal niet, zelfs niet als heet.
2. Filtering Hot: Hoewel heet, wordt de oplossing gefilterd om onoplosbare onzuiverheden te verwijderen. Dit wordt snel gedaan om voortijdige kristallisatie te voorkomen.
3. Koeling en kristallisatie: De oplossing wordt langzaam afgekoeld, waardoor de gewenste verbinding kan kristalliseren naarmate de oplosbaarheid afneemt.
4. Filtering Cold: Eenmaal gekoeld, worden de kristallen gefilterd om ze te scheiden van de resterende oplossing (die de opgeloste onzuiverheden bevatten).
5. Wassen en drogen: De kristallen worden gewassen met een kleine hoeveelheid koud oplosmiddel om eventuele resterende onzuiverheden te verwijderen en vervolgens gedroogd om resterend oplosmiddel te verwijderen.
Sleutelpunten:
* Keuze van oplosmiddel: De sleutel tot succesvolle herkristallisatie is het selecteren van een oplosmiddel dat een groot verschil in oplosbaarheid heeft voor de gewenste verbinding bij hoge en lage temperaturen.
* langzame koeling: Langzame koeling zorgt voor de vorming van grotere, zuiverdere kristallen.
* onzuiverheden: Onzuiverheden die gemakkelijk oplossen in het oplosmiddel blijven in de oplossing, terwijl die onoplosbaar worden verwijderd tijdens de initiële hete filtratie.
* Meerdere herkristallisaties: Soms is een enkele herkristallisatie misschien niet voldoende om een hoge zuiverheid te bereiken. Meerdere herkristallisatiestappen kunnen de zuiverheid verder vergroten.
Voorbeeld:
Laten we zeggen dat je een mengsel van zout (NaCl) en suiker (C12H22O11) hebt. U kunt ze scheiden met herkristallisatie.
* oplosmiddel: Water is een goede keuze. Zout is erg oplosbaar in water, zowel warm als koud. Suiker is veel meer oplosbaar in heet water dan koud water.
* oplossen: Los het mengsel op in heet water.
* Filtering Hot: Verwijder eventuele onoplosbare onzuiverheden (indien aanwezig).
* Koeling: Terwijl de oplossing afkoelt, kristalliseert suiker, waardoor het zout in het water wordt opgelost.
* Filtering Cold: Verzamel de suikerkristallen en was ze met koud water om eventueel zout te verwijderen.
Toepassingen:
Herkristallisatie is een veelgebruikte techniek in chemie en aanverwante velden, waaronder:
* zuivering van verbindingen: Het is essentieel voor het zuiveren van organische verbindingen, geneesmiddelen en andere chemicaliën.
* Pure kristallen verkrijgen: Kristallen verkregen door herkristallisatie worden vaak gebruikt in onderzoek, materiaalwetenschap en andere gebieden.
Laat het me weten als je nog andere vragen hebt!
 Waarom heeft een chloride-ion een grotere straal dan een chlooratoom?
Waarom heeft een chloride-ion een grotere straal dan een chlooratoom?  Wat is een onzuivere stof die verschillende elementen en of verbindingen combineert?
Wat is een onzuivere stof die verschillende elementen en of verbindingen combineert?  Waarom verwijdert fosforzuur roest?
Waarom verwijdert fosforzuur roest?  Waarom zijn de coëfficiënten slechts een deel van de chemische formule die tijdens een reactie kan worden gewijzigd?
Waarom zijn de coëfficiënten slechts een deel van de chemische formule die tijdens een reactie kan worden gewijzigd?  Hoe wordt de opgeloste stof genoemd als oplosmiddelwater?
Hoe wordt de opgeloste stof genoemd als oplosmiddelwater?
 Politiek studeren? Enorme database met politieke opvattingen en keuzes, nu van jou
Politiek studeren? Enorme database met politieke opvattingen en keuzes, nu van jou  Toekomstige oceaansteden hebben groene techniek boven en onder de waterlijn nodig
Toekomstige oceaansteden hebben groene techniek boven en onder de waterlijn nodig Nieuw model komt overeen met oud:nucleaire oorlog tussen de VS en Rusland zou resulteren in een nucleaire winter
Nieuw model komt overeen met oud:nucleaire oorlog tussen de VS en Rusland zou resulteren in een nucleaire winter Mysterie over hoe slangen hun poten verloren, opgelost door reptielfossielen
Mysterie over hoe slangen hun poten verloren, opgelost door reptielfossielen  Maritieme industrie zoekt oplossingen om vervuiling te beperken
Maritieme industrie zoekt oplossingen om vervuiling te beperken
Hoofdlijnen
- Wat waren de namen van twee wetenschappers die DNA ontdekten?
- Wat is een Thermobar?
- Wat is de naam van gespecialiseerd enzym dat poly-a-tail toevoegt?
- Losse huid en slap volume beschermen Hagfish tegen haaienbeten
- Wanneer en waar bossen beschermen
- Hoe een parasitaire schimmel het zenuwstelsel van vliegen kaapt
- Hoe leven met roofdieren inheemse soorten kan helpen overleven
- Uit onderzoek blijkt dat planten droogtestresshormonen gebruiken om snackende spintmijten te blokkeren
- Gespecialiseerde cellen in het lichaam
- Een nieuwe bètavoltaïsche technologie met kleurstoffen voor een betere energieproductie

- Computationele strategieën overwinnen obstakels bij de ontwikkeling van peptidetherapieën

- Onderzoeksconsortium produceert 3D-kaart met hoge resolutie van GLP-1R
- Schimmelinfectie van het hoornvlies behandelen met synthetische moleculen

- Nieuw, gevoeliger sensor voor het evalueren van de veiligheid van geneesmiddelen
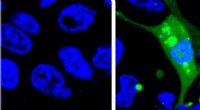
 Ruimte-app voor piloten gaat de lucht in
Ruimte-app voor piloten gaat de lucht in Niet-aviaire dinosaurus blijkt blauwe eieren te hebben gelegd
Niet-aviaire dinosaurus blijkt blauwe eieren te hebben gelegd Astronomen detecteren een chromosferisch actief verduisterend binair systeem
Astronomen detecteren een chromosferisch actief verduisterend binair systeem Hybride materiaal als bladgoudvervanger
Hybride materiaal als bladgoudvervanger Hoe beïnvloedt het klimaat de manier waarop mensen om ons heen leven?
Hoe beïnvloedt het klimaat de manier waarop mensen om ons heen leven?  Trillingen duwen de staat Washington naar het westen, bieden aanwijzingen voor de volgende grote aardbeving
Trillingen duwen de staat Washington naar het westen, bieden aanwijzingen voor de volgende grote aardbeving De beste plaatsen om windturbines elektriciteit te laten produceren
De beste plaatsen om windturbines elektriciteit te laten produceren De impact van technologische materialen voor de koolstofarme transitie beperken
De impact van technologische materialen voor de koolstofarme transitie beperken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

