
Wetenschap
Waarom verwijdert fosforzuur roest?
Fosforzuur is een zwak zuur dat veel wordt gebruikt in de voedingsmiddelen- en drankenindustrie. Het wordt ook gebruikt in schoonmaakmiddelen en metaalbewerkingsvloeistoffen. Fosforzuur reageert met ijzeroxiden en vormt ijzerfosfaten. IJzerfosfaten zijn stabieler dan ijzeroxiden en daardoor beter bestand tegen corrosie. Dit is de reden waarom fosforzuur effectief is bij het verwijderen van roest.
De reactie tussen fosforzuur en ijzeroxiden kan worden weergegeven door de volgende vergelijking:
Fe2O3 + 2H3PO4 → 2FePO4 + 3H2O
In deze vergelijking staat Fe2O3 voor ijzer(III)oxide, H3PO4 voor fosforzuur, FePO4 voor ijzer(II)fosfaat en H2O voor water.
De reactie tussen fosforzuur en ijzeroxiden is een chemische reactie. Dit betekent dat de atomen in de reactanten worden herschikt om nieuwe producten te vormen. In dit geval worden de ijzeratomen in de ijzeroxiden herschikt om ijzer(II)fosfaat te vormen.
Fosforzuur is niet het enige zuur dat roest kan verwijderen. Andere zuren, zoals zoutzuur en zwavelzuur, kunnen ook worden gebruikt. Fosforzuur heeft echter vaak de voorkeur omdat het minder corrosief en minder giftig is dan andere zuren.
 Halogeenbinding-gemedieerde metaalvrije gecontroleerde kationische polymerisatie
Halogeenbinding-gemedieerde metaalvrije gecontroleerde kationische polymerisatie De meeste calciumatomen hebben een atoomnummer van 20 en een massa van 40, maar sommige zijn 48. Welk woord zou je kunnen gebruiken om deze twee soorten atomen te beschrijven?
De meeste calciumatomen hebben een atoomnummer van 20 en een massa van 40, maar sommige zijn 48. Welk woord zou je kunnen gebruiken om deze twee soorten atomen te beschrijven?  Doorbraakmateriaal kan leiden tot goedkopere, meer wijdverbreide zonnepanelen en elektronica
Doorbraakmateriaal kan leiden tot goedkopere, meer wijdverbreide zonnepanelen en elektronica Goedkope, vieze restjes kunnen pure zuurstof vrijgeven:zeshoekige manganieten zijn veelbelovend voor productie op industriële schaal
Goedkope, vieze restjes kunnen pure zuurstof vrijgeven:zeshoekige manganieten zijn veelbelovend voor productie op industriële schaal  Enzymatische photocaging voor de studie van genregulatie door middel van DNA-methylatie
Enzymatische photocaging voor de studie van genregulatie door middel van DNA-methylatie
 Groene infrastructuur om intenser regenwater te beheren met klimaatverandering
Groene infrastructuur om intenser regenwater te beheren met klimaatverandering NASA vindt tropische storm Jongdari nu kommavormig
NASA vindt tropische storm Jongdari nu kommavormig We hebben eindelijk het gezoem op de bodem van de zee opgenomen
We hebben eindelijk het gezoem op de bodem van de zee opgenomen  Prei-orchideeën zijn mooi, bedreigd en we hebben geen idee hoe we ze moeten kweken
Prei-orchideeën zijn mooi, bedreigd en we hebben geen idee hoe we ze moeten kweken  Rode vloed trekt zich terug:slechts twee locaties in Florida testen positief bij de laatste dagelijkse controles
Rode vloed trekt zich terug:slechts twee locaties in Florida testen positief bij de laatste dagelijkse controles
Hoofdlijnen
- De eerste stappen van een cel:een model bouwen om uit te leggen hoe cellen groeien
- Industrieel gebruik van Pepsin
- Is meer beter? Hoeveelheden en frequentie van kunstmelk aan kalveren onder hittestress
- Wat is cafeïne? | Hoe dingen werken
- Onderzoek onthult inzichten in de evolutie van eiwitten
- Noem de reatanten en producten van fotosynthese-ademhaling?
- Ontdekking onthult hoe bacteriën schadelijke en nuttige virussen onderscheiden
- Aziatische vlinderpopulaties vertonen verschillende mimicry-patronen dankzij genetische 'switch'
- Gebruik van microscopen in Science
- Veel kleine verschillen dragen bij aan een grote variatie
- Chemische en optische beeldvorming verklaren waarom een roos zijn kleur verloor op een beroemd schilderij
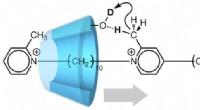
- Moleculaire machine maakt gebruik van beweging in één richting
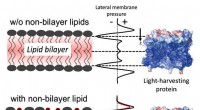
- Team ontdekt een mechanisme dat planten gebruiken om fotosynthese in te schakelen
- Zeewater levert eerste gram yellowcake op:garenachtig materiaal verzamelt tot nu toe de grootste hoeveelheid uranium

 Wat zijn aanpassingen in planten?
Wat zijn aanpassingen in planten?  Snelste sterren in de Melkweg zijn weglopers uit een ander sterrenstelsel
Snelste sterren in de Melkweg zijn weglopers uit een ander sterrenstelsel De geschiedenis van de Australische vegetatie uitleggen
De geschiedenis van de Australische vegetatie uitleggen Wat zijn kenmerken van Tornado's?
Wat zijn kenmerken van Tornado's?  Afgeleide chauffeurs 29 keer meer kans om te verongelukken in een werkgebied op de snelweg
Afgeleide chauffeurs 29 keer meer kans om te verongelukken in een werkgebied op de snelweg Video:Hoe de baan van de aarde vrij te maken van ruimtepuin
Video:Hoe de baan van de aarde vrij te maken van ruimtepuin Homemade Squirrel Feeders voor kinderen
Homemade Squirrel Feeders voor kinderen  Amerikaanse vrouwen schatten te veel (en te weinig) in hoeveel kinderen ze zullen krijgen
Amerikaanse vrouwen schatten te veel (en te weinig) in hoeveel kinderen ze zullen krijgen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

