
Wetenschap
Eigenschappen die de smelt- en kookpunten van een molecuul beïnvloeden?
1. Intermoleculaire krachten (IMF's):
* waterstofbinding: Het sterkste type IMF. Treedt op wanneer waterstof wordt gebonden aan zeer elektronegatieve atomen zoals zuurstof, stikstof of fluor. Moleculen die waterstofbruggen kunnen vormen, hebben aanzienlijk hogere smelt- en kookpunten. (bijv. Water, alcoholen)
* Dipole-dipole interacties: Komen tussen polaire moleculen op met permanente dipolen. Zwakker dan waterstofbindingen, maar dragen nog steeds bij aan hogere smelt- en kookpunten. (bijv. Aceton, chloroform)
* London Dispersion Forces (LDFS): Aanwezig in alle moleculen, ongeacht polariteit. Deze krachten komen voort uit tijdelijke, geïnduceerde dipolen. De sterkte van LDF's neemt toe met de grootte en het molecuulgewicht van het molecuul. (bijv. Koolwaterstoffen zoals methaan, propaan, butane)
2. Moleculaire vorm en grootte:
* oppervlakte: Moleculen met grotere oppervlakken hebben meer contactpunten voor IMF -interacties, wat leidt tot hogere smelt- en kookpunten.
* vertakking: Vertakte moleculen hebben minder oppervlakte voor contact, wat leidt tot zwakkere IMF's en lagere smelt- en kookpunten in vergelijking met niet -verbogen isomeren.
3. Molecuulgewicht:
* Zwaardere moleculen hebben sterkere LDF's, wat resulteert in hogere smelt- en kookpunten. Dit is vooral belangrijk voor niet-polaire moleculen waarbij LDF's de primaire intermoleculaire kracht zijn.
4. Polariseerbaarheid:
* Polariseerbaarheid verwijst naar het gemak waarmee de elektronenwolk van een molecuul kan worden vervormd. Meer polariseerbare moleculen hebben sterkere LDF's, wat leidt tot hogere smelt- en kookpunten.
5. Kristallijne structuur:
* De opstelling van moleculen in een vaste stof kan het smeltpunt beïnvloeden. Meer geordende kristallijne structuren hebben over het algemeen hogere smeltpunten.
illustratieve voorbeelden:
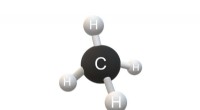
* water (h₂o): Sterke waterstofbinding resulteert in een zeer hoog smeltend en kookpunt (0 ° C en 100 ° C).
* methaan (ch₄): Alleen LDF's, dus het heeft een zeer laag smelt- en kookpunt (-182 ° C en -164 ° C).
* ethanol (ch₃ch₂oh): Waterstofbinding, dus het heeft een hoger smelt- en kookpunt dan ethaan (ch₃ch₃), dat alleen LDF's heeft.
* pentane (c₅h₁₂): Hoger molecuulgewicht dan butaan (c₄h₁₀), dus het heeft een hoger kookpunt.
Samenvatting:
De smeltende en kookpunten van een molecuul worden bepaald door een combinatie van factoren, voornamelijk de sterkte van intermoleculaire krachten, moleculaire grootte en vorm. Inzicht in deze eigenschappen helpt de fysieke eigenschappen van stoffen te voorspellen en te verklaren.
 Welke term verwijst naar de niet-levende factoren van de omgeving?
Welke term verwijst naar de niet-levende factoren van de omgeving?  Om conservatieve klimaattegenstanders echt te laten luisteren, probeer hun taal te spreken
Om conservatieve klimaattegenstanders echt te laten luisteren, probeer hun taal te spreken Is jouw boterham slecht voor het milieu?
Is jouw boterham slecht voor het milieu?  Standpunt:Klimaatchaos beteugelen – waarom de natuur de onbezongen held is in onze zoektocht naar het netto nulpunt
Standpunt:Klimaatchaos beteugelen – waarom de natuur de onbezongen held is in onze zoektocht naar het netto nulpunt  Wetenschappers bestuderen veranderingen in de biodiversiteit van de zandstranden van Californië
Wetenschappers bestuderen veranderingen in de biodiversiteit van de zandstranden van Californië
Hoofdlijnen
- Welk insect bleek industrieel melanisme te hebben?
- Kwakzalvermedicijnen, insectenimmigranten en wat er eet tussen geheimen onthuld door DNA-barcodes
- Welk proces veroorzaakt het verkeerd lezen van bacterie -mRNA en break -up polysomen?
- Hoe Flow Cytometry-resultaten te begrijpen
- Computersimulaties visualiseren hoe een essentieel stamceleiwit het verpakte DNA opent
- Hoe technologie een revolutie teweegbrengt in het insectenonderzoek
- Genoomsequenties laten zien hoe lemuren infecties bestrijden
- Wat hebben alle levende organismen gemeen?
- Chronische verspillende ziekte:de problemen met de prionziekte van hertachtigen aanpakken
- Tandemkatalyse verbetert selectieve oxidatie van methaan tot oxygenaten
- Geïdentificeerd:Moleculaire structuur die een belangrijk onderdeel van smog afbreekt

- Fotokatalytische nanovezels ontwikkeld voor gebruik bij efficiënte waterstofproductie

- Onderzoekers ontwikkelen taaie, zelfherstellend rubber

- Zuurtolerant groen fluorescerend eiwit voor bio-imaging
 3D-geprinte Biomesh minimaliseert hernia-reparatiecomplicaties
3D-geprinte Biomesh minimaliseert hernia-reparatiecomplicaties Hoeveel protonen en elektronen zijn er in het jodide -ion?
Hoeveel protonen en elektronen zijn er in het jodide -ion?  Blijf positief, Scott Morrison:als je mensen uitscheldt voor slecht gedrag, ze doen het meer
Blijf positief, Scott Morrison:als je mensen uitscheldt voor slecht gedrag, ze doen het meer Wat is de grootste canyon in het zonnestelsel?
Wat is de grootste canyon in het zonnestelsel?  Waarom zijn de twee lagen fosfolipiden op een celmembraan gerangschikte manier?
Waarom zijn de twee lagen fosfolipiden op een celmembraan gerangschikte manier?  Diagrammen ongelijkheden op een getallenlijn tekenen
Diagrammen ongelijkheden op een getallenlijn tekenen Onderzoekers slagen erin om attoseconde pulsen te genereren met een herhalingsfrequentie van 100 kHz
Onderzoekers slagen erin om attoseconde pulsen te genereren met een herhalingsfrequentie van 100 kHz Ernst van de misdaad vergroot het geloof in schuld van jury's:studie
Ernst van de misdaad vergroot het geloof in schuld van jury's:studie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

