
Wetenschap
Hoe beïnvloedt een temperatuurstijging het vermogen van een gas om in oplossing te gaan?
* Oplosbaarheid en temperatuur: De oplosbaarheid van een gas in een vloeistof is direct gerelateerd aan de partiële druk van het gas boven de vloeistof. Temperatuur speelt echter een belangrijke rol in deze relatie.
* Kinetische energie: Wanneer u de temperatuur verhoogt, verhoogt u de kinetische energie van de gasmoleculen. Deze moleculen bewegen sneller en hebben meer energie, waardoor het voor hen gemakkelijker wordt om te ontsnappen aan de vloeibare fase en terug te keren naar de gasvormige fase.
* evenwichtsverschuiving: Het oplossen van een gas in een vloeistof is een evenwichtsproces. Het verhogen van de temperatuur verschuift het evenwicht naar de gasvormige toestand, waardoor de hoeveelheid gas in de vloeistof wordt opgelost.
Denk er op deze manier aan: Stel je een gas in een vloeistof voor. Naarmate de temperatuur stijgt, worden de gasmoleculen enthousiast en "stuiteren" meer rond. Ze zullen eerder loskomen van de aantrekkelijke krachten die ze in de vloeistof houden en ontsnappen in de lucht hierboven.
Voorbeelden:
* koolzuurhoudende dranken: Wanneer u een blik of fles frisdrank opent, ontsnapt het gas (CO2) omdat de druk wordt vrijgegeven en de temperatuur van het drankje toeneemt.
* kokend water: Terwijl water kookt, komen de opgeloste gassen zoals zuurstof en stikstof vrij, wat leidt tot de vorming van bubbels.
Uitzonderingen:
Hoewel de algemene regel is dat het verhogen van de temperatuur de oplosbaarheid van de gasverlies verlaagt, zijn er enkele uitzonderingen. Sommige gassen, zoals ammoniak (NH3), worden eigenlijk meer oplosbaar in water bij hogere temperaturen. Deze uitzonderingen zijn vaak te wijten aan complexe chemische interacties tussen het gas en het oplosmiddel.
Samenvattend: Toenemende temperatuur maakt het in het algemeen moeilijker voor gassen om op te lossen in vloeistoffen, omdat de verhoogde kinetische energie van de gasmoleculen hun ontsnapping uit oplossing bevordert.
 Katalysatoronderzoek laat zien hoe computers het giswerk uit de chemie kunnen wegnemen
Katalysatoronderzoek laat zien hoe computers het giswerk uit de chemie kunnen wegnemen  Wat is een gesmolten alkali?
Wat is een gesmolten alkali?  Bestaat er een zuur dat sterker is dan lava?
Bestaat er een zuur dat sterker is dan lava?  Kleurenwieltheorie:hoe erover te praten
Kleurenwieltheorie:hoe erover te praten  Van insect tot medicijn - speeksel van teken kan de sleutel zijn tot de behandeling van hartaandoeningen
Van insect tot medicijn - speeksel van teken kan de sleutel zijn tot de behandeling van hartaandoeningen
 Wat veroorzaakt de meest mysterieuze aardbevingen in de diepe aarde?
Wat veroorzaakt de meest mysterieuze aardbevingen in de diepe aarde? Onaanvaardbare kosten:savanneverbranding onder het Australische koolstofkredietschema schaadt de menselijke gezondheid
Onaanvaardbare kosten:savanneverbranding onder het Australische koolstofkredietschema schaadt de menselijke gezondheid Nieuwe studie toont persistentie van smeltwaterbiodiversiteit ondanks gletsjerverlies
Nieuwe studie toont persistentie van smeltwaterbiodiversiteit ondanks gletsjerverlies Wetenschappers kijken naar de lucht om de detectie van tsunami's te verbeteren
Wetenschappers kijken naar de lucht om de detectie van tsunami's te verbeteren Klimaatonderzoeker:Nu actie ondernemen tegen klimaatverandering is onze beste kans op een aanvaardbare toekomst
Klimaatonderzoeker:Nu actie ondernemen tegen klimaatverandering is onze beste kans op een aanvaardbare toekomst
Hoofdlijnen
- Onderzoekers verkennen snoekbaarzen voor aquacultuur
- Een dunne laag die de buitenkant van cellen bedekt?
- Wat zijn enkele voorbeelden van wetenschappelijke teksten?
- Hoe sneller ze komen:hoe de sociale status tussen vissen wordt onderhandeld
- Wat is de functie van spicula?
- Ziekte in het vuil:hoe schurftveroorzakende mijten een Tasmaanse wombatpopulatie hebben gedecimeerd
- Wat zijn de belangrijkste intermoleculaire krachten van xenon?
- Wat zijn de vier basiseenheden afgeleid van voedsel?
- Welke verhouding in eukaryotische cellen coderen voor eiwitten of structureel RNA?
- Nieuwe technologie zet zonlicht, water en koolstofdioxide om in acetaat en zuurstof voor hoogwaardige brandstoffen en chemicaliën
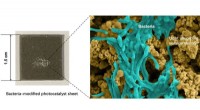
- Lab-on-a-chip helpt bij het zoeken naar menselijk DNA op plaats delict

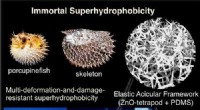
- Porcupinefish inspireert stevig superhydrofoob materiaal
- Dansende materie:nieuwe vorm van beweging van cyclische macromoleculen ontdekt

- Onderzoekers ontwikkelen flexibel kristal, de weg vrijmaken voor efficiëntere buigbare elektronica

 Welke vloeistof is niet nat?
Welke vloeistof is niet nat?  Economisch herstel COVID:hoe zou een groene stimulans eruit kunnen zien?
Economisch herstel COVID:hoe zou een groene stimulans eruit kunnen zien? Zijn veelvraat in het noordpoolgebied in het vizier van klimaatverandering?
Zijn veelvraat in het noordpoolgebied in het vizier van klimaatverandering? Beruchte beveiligingsbedreigingen elimineren
Beruchte beveiligingsbedreigingen elimineren Een metaal kan in dunne vellen worden gehamerd omdat het dat is?
Een metaal kan in dunne vellen worden gehamerd omdat het dat is?  China waarschuwt voor ernstige oogstdreiging door ergste hittegolf ooit
China waarschuwt voor ernstige oogstdreiging door ergste hittegolf ooit Wat gebeurt er als geladen voorwerpen dichtbij de neutrale voorwerpen worden geplaatst?
Wat gebeurt er als geladen voorwerpen dichtbij de neutrale voorwerpen worden geplaatst?  Perfecte dranken en vloeibare voeding tot op moleculair niveau
Perfecte dranken en vloeibare voeding tot op moleculair niveau
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

