
Wetenschap
Waarom chloormoleculen ontleden en Cl-vrije radicalen opleveren, leg dit uit in termen van kc?
Cl2 (g) ⇌ 2 Cl (g)
De evenwichtsconstante (Kc) voor deze reactie wordt gegeven door de uitdrukking:
Kc =[Cl]^2/[Cl2]
waarbij [Cl] de evenwichtsconcentratie van vrije chloorradicalen is en [Cl2] de evenwichtsconcentratie van chloormoleculen is.
Bij een gegeven temperatuur bepaalt de waarde van Kc de mate waarin Cl2-moleculen ontleden in Cl-vrije radicalen. Een hogere Kc-waarde duidt op een grotere neiging van Cl2 om te dissociëren, wat resulteert in een hogere concentratie van Cl-vrije radicalen bij evenwicht.
Factoren die de waarde van Kc voor de ontleding van Cl2 beïnvloeden zijn onder meer temperatuur en druk. Over het algemeen neemt Kc toe met toenemende temperatuur. Dit komt omdat hogere temperaturen meer energie aan de Cl2-moleculen leveren, waardoor ze de activeringsenergiebarrière kunnen overwinnen die nodig is voor dissociatie. Als gevolg hiervan dissociëren meer Cl2-moleculen in Cl-vrije radicalen, wat leidt tot een hogere evenwichtsconcentratie van Cl.
Aan de andere kant heeft druk een relatief klein effect op de waarde van Kc voor de ontleding van Cl2. Dit komt omdat de reactie geen significante verandering in het aantal mol gas met zich meebrengt. Daarom hebben drukveranderingen geen significante invloed op de evenwichtspositie van de reactie.
Samenvattend is de ontleding van chloormoleculen om vrije chloorradicalen te vormen een temperatuurafhankelijk proces dat wordt bepaald door de evenwichtsconstante Kc. Hogere temperaturen bevorderen de vorming van Cl-vrije radicalen, terwijl druk een relatief kleine invloed heeft op de evenwichtspositie van de reactie.
 Is uw machine learning-trainingsset bevooroordeeld? Hoe nieuwe medicijnen te ontwikkelen op basis van samengevoegde datasets
Is uw machine learning-trainingsset bevooroordeeld? Hoe nieuwe medicijnen te ontwikkelen op basis van samengevoegde datasets Wetenschappers laten zien hoe ze een katalysator kunnen beheersen die een broeikasgas in een brandstof of grondstof verandert
Wetenschappers laten zien hoe ze een katalysator kunnen beheersen die een broeikasgas in een brandstof of grondstof verandert Roestige polymeren maken voor energieopslag
Roestige polymeren maken voor energieopslag Wetenschappers creëren afstembare schelpen om kleine druppeltjes in te kapselen
Wetenschappers creëren afstembare schelpen om kleine druppeltjes in te kapselen  Wat is de molaire massa van B10H14?
Wat is de molaire massa van B10H14?
 Wordt wat recyclen eigenlijk gerecycled?
Wordt wat recyclen eigenlijk gerecycled?  Het lokeffect:hoe je wordt beïnvloed om te kiezen zonder het echt te weten
Het lokeffect:hoe je wordt beïnvloed om te kiezen zonder het echt te weten  Lokale interventies vergroten de veerkracht van koralen tegen verbleking
Lokale interventies vergroten de veerkracht van koralen tegen verbleking Aqua-satelliet ziet tropische depressie Bolaven vechten tegen windschering
Aqua-satelliet ziet tropische depressie Bolaven vechten tegen windschering Zuidelijke steden zwaar getroffen door stormen krijgen te maken met nieuwe crisis:geen water
Zuidelijke steden zwaar getroffen door stormen krijgen te maken met nieuwe crisis:geen water
Hoofdlijnen
- Waarom hebben wetenschappers genetische modificatie toegepast op groenten en fruit?
- Wat gebeurt er als weefsel wordt aangevallen door een virus?
- De effectiviteit van camouflage bij verschillende dieren vergelijken
- Zoekers in Mexico vinden, maar laat los, vaquita bruinvis kalf
- Hoe oude planten water begonnen te gebruiken toen ze naar het land verhuisden
- Onderzoekers werpen nieuw licht op gopherschildpadden
- Heeft messenger-RNA een fosfaatgroep?
- Het Y-chromosoom verdwijnt – dus wat zal er met mannen gebeuren?
- Meer dan 38 procent van de Neotropische papegaaienpopulatie op het Amerikaanse continent wordt bedreigd door menselijke activiteit
- Op zoek naar een uit-schakelaar voor coeliakie
- Wetenschappers ontdekken groenere route naar veelgebruikt industrieel materiaal

- Durian skin-biocomposiet voor afhaalcontainers en 3D-printen

- Gebruik maken van de zon om vers water te brengen naar afgelegen of door rampen getroffen gemeenschappen

- Een algenfoto-enzym dat blauw licht gebruikt om vetzuren om te zetten in koolwaterstoffen
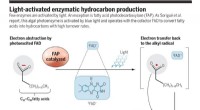
 Uit gecorrigeerde zonnevlekkengegevens blijkt dat het Maunder-minimum niet abrupt eindigde
Uit gecorrigeerde zonnevlekkengegevens blijkt dat het Maunder-minimum niet abrupt eindigde  Wat doet veel van de activiteiten van een cel?
Wat doet veel van de activiteiten van een cel?  Hoe een pauze leerlingen helpt bij het leren
Hoe een pauze leerlingen helpt bij het leren Wat voor soort wolken zijn regenwolken?
Wat voor soort wolken zijn regenwolken?  De dynamiek van helder-donker excitonovergang in een halfgeleidermateriaal
De dynamiek van helder-donker excitonovergang in een halfgeleidermateriaal  Onderzoekers printen kanaalstructuren in kwartsglas
Onderzoekers printen kanaalstructuren in kwartsglas Microsoft sluit studio voor Xbox-televisieshow
Microsoft sluit studio voor Xbox-televisieshow  Studie levert een gedetailleerd chemisch profiel op van luchtvervuilingsbronnen in Delhi
Studie levert een gedetailleerd chemisch profiel op van luchtvervuilingsbronnen in Delhi
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

