Wetenschap
Op zoek naar een uit-schakelaar voor coeliakie
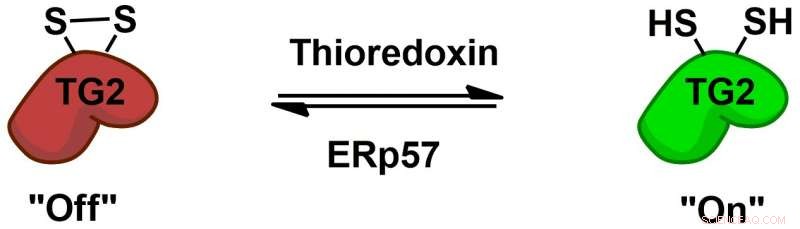
Transglutaminase 2 (TG2) wordt omkeerbaar gereguleerd door de eiwitcofactoren thioredoxine en ERp57 via een allosterische disulfide-redox-schakelaar. Krediet:Chaitan Khosla, Stanford universiteit
Coeliakie is een auto-immuunziekte die volgens sommige schattingen bijna 1 op de 100 mensen treft. Symptomen van coeliakie worden veroorzaakt door gluten, een eiwit dat voorkomt in tarwe en verwante planten, maar gluten werkt niet alleen om de spijsverteringssymptomen te veroorzaken waaraan patiënten lijden. Liever, gluten induceert een overactieve immuunrespons wanneer het wordt gemodificeerd door het enzym transglutaminase 2, of TG2, in de dunne darm. Nieuw onderzoek gepubliceerd in het nummer van 23 februari van de Tijdschrift voor biologische chemie identificeert een enzym dat TG2 uitschakelt mogelijk de weg vrijmaakt voor nieuwe behandelingen voor coeliakie.
"Momenteel, therapieën om mensen met coeliakie te behandelen ontbreken. De beste aanpak op dit moment is gewoon een strikte naleving van een levenslang glutenvrij dieet, " zei Michael Yi, een afgestudeerde student chemische technologie aan de Stanford University die de nieuwe studie leidde. "Misschien is de reden hierachter ons relatief slechte begrip van TG2."
De biochemie van hoe TG2 interageert met gluten en een immuunrespons induceert, is goed bestudeerd, maar er blijven meer fundamentele mysteries, bijvoorbeeld hoe TG2 zich gedraagt bij mensen zonder coeliakie. Chaitan Khosla, de professor aan Stanford en directeur van Stanford Chemistry, Engineering &Medicine for Human Health, die toezicht hield op de nieuwe studie, heeft verschillende onderzoeken uitgevoerd waaruit blijkt dat TG2 actief of inactief kan zijn, afhankelijk van het vormen of verbreken van een specifieke chemische binding, een disulfidebinding genoemd, tussen twee aminozuren in het enzym.
"(E) hoewel er veel transglutaminase 2-eiwit in de (dunne darm), het is allemaal inactief, " zei Khosla. "Toen het duidelijk werd dat hoewel het eiwit overvloedig was, zijn activiteit was niet aanwezig in een gezond orgaan, de vraag werd 'Wat zet het eiwit aan, en wat schakelt het eiwit dan uit?'"In 2011 Het team van Khosla identificeerde het enzym dat TG2 activeert door de disulfidebinding te verbreken. In de nieuwe krant de onderzoekers deden experimenten in celculturen en vonden een enzym dat deze binding opnieuw vormt, het deactiveren van TG2. Dit enzym, ERp57, staat vooral bekend om het helpen vouwen van eiwitten in de cel. Wanneer het TG2 uitschakelt, het doet dit buiten de cellen, roept meer vragen op over de functies ervan bij gezonde mensen.
"Niemand begrijpt echt hoe (Erp57) buiten de cel komt, ' zei Khosla. 'De algemene gedachte is dat het in kleine hoeveelheden uit de cel wordt geëxporteerd; deze specifieke observatie suggereert dat het daadwerkelijk een biologische rol heeft buiten de cel."
TG2 is nu ook het eerste eiwit waarvan bekend is dat het een omkeerbare disulfidebinding aan/uit-schakelaar van dit type heeft. "Dit is een heel ander soort aan-en-uit chemie dan het soort dat medicinale chemici (meestal) zouden gebruiken, ' zei Khosla.
Het begrijpen van dit mechanisme heeft ertoe geleid dat het team heeft onderzocht of er door de FDA goedgekeurde medicijnen zijn die de omschakeling direct kunnen aanpakken. Omdat eerdere studies hebben gesuggereerd dat een gebrek aan TG2 de gezondheid van muizen niet negatief lijkt te beïnvloeden, het blokkeren van TG2 is een veelbelovende manier voor de behandeling van patiënten met coeliakie zonder dat levenslange veranderingen in hun dieet nodig zijn.
 Chemici lossen hardnekkig probleem op na vier decennia
Chemici lossen hardnekkig probleem op na vier decennia De universele waarheid over plakkerige oppervlakken
De universele waarheid over plakkerige oppervlakken Botuline-achtige toxines springen over naar een nieuw soort bacterie
Botuline-achtige toxines springen over naar een nieuw soort bacterie Onderzoekers produceren kosteneffectieve, milieuvriendelijk glasmateriaal
Onderzoekers produceren kosteneffectieve, milieuvriendelijk glasmateriaal Nieuwe methode ontwikkeld om antibioticaresten in voedsel uit dierlijke bronnen te extraheren
Nieuwe methode ontwikkeld om antibioticaresten in voedsel uit dierlijke bronnen te extraheren
Hoofdlijnen
- Accuplacer-regels
- Antibioticaresistentie:onderzoekers slagen erin resistentiegenen te blokkeren
- Hebben mensen en bananen echt 50 procent van hetzelfde DNA?
- Syngenta schikt Amerikaanse boerenrechtszaken in Chinese maïshandelzaak
- Stamcelplatform werpt nieuw licht op het begin van menselijke ontwikkeling
- Kun je verslaafd zijn aan endorfine?
- Welke stadia zijn er in de mitochondriën?
- Hoe vangen cellen energie die vrijkomt door cellulaire ademhaling?
- Wat is de relatie tussen stikstofbasen en de genetische code?
 Supergeleiding met twee koepels in een Kagome-supergeleider ontdekt onder hoge druk
Supergeleiding met twee koepels in een Kagome-supergeleider ontdekt onder hoge druk DC spanning koud plasma technologie voor een veiliger, meer kosteneffectieve benadering om medische hulpmiddelen te steriliseren
DC spanning koud plasma technologie voor een veiliger, meer kosteneffectieve benadering om medische hulpmiddelen te steriliseren Is vuur het nieuwe normaal in het Amerikaanse Westen?
Is vuur het nieuwe normaal in het Amerikaanse Westen? Zoutafzettingen op Mars bevatten aanwijzingen voor bronnen van oud water
Zoutafzettingen op Mars bevatten aanwijzingen voor bronnen van oud water Universele optische methode voor het observeren van fysieke, chemische of biologische processen op nanoschaal
Universele optische methode voor het observeren van fysieke, chemische of biologische processen op nanoschaal Cowpea beschermd tegen een verwoestende plaag, gratis voor kleine Afrikaanse boeren
Cowpea beschermd tegen een verwoestende plaag, gratis voor kleine Afrikaanse boeren Veiligheidsmaatregelen bij het gebruik van vlammen in de wetenschap
Veiligheidsmaatregelen bij het gebruik van vlammen in de wetenschap  Wereldwijde tol door aardverschuivingen is het zwaarst in ontwikkelingslanden
Wereldwijde tol door aardverschuivingen is het zwaarst in ontwikkelingslanden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Swedish | German | Dutch | Danish | Norway | French | Portuguese |

-
Wetenschap © https://nl.scienceaq.com