
Wetenschap
Tubuline-remmer met een uniek moleculair werkingsmechanisme
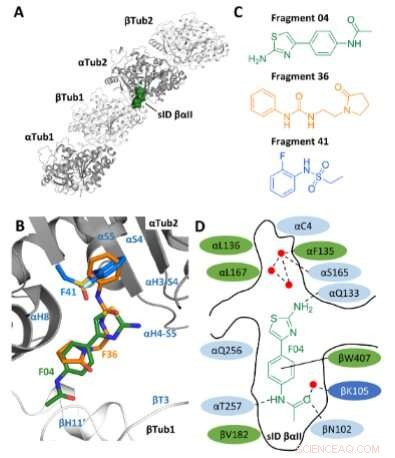
Fragment selectie. A) Locatie van de site sID βαII (volumeweergave) bij de βTub1-αTub2 interdimeerinterface van de T2 R-TTL-complex. Voor de eenvoud zijn de RB3- en TTL-ketens niet weergegeven. De twee α- en twee β-tubuline-monomeren in de T2 Het R-TTL-complex wordt respectievelijk weergegeven in grijze en witte lintweergave. B) Superpositie van de F04-, F36- en F41-bindende poses (respectievelijk VOB-ID's 5S4O, 5S5K en 5S5P). Secundaire structuurelementen van tubuline zijn blauw gemarkeerd. Koolstofatomen zijn groen gekleurd voor F04, oranje voor fragment F36 en lichtblauw voor fragment F41. Stikstofatomen zijn blauw gekleurd, zuurstofatomen rood, zwavelatomen geel en fluoratomen lichtgroen. C) Chemische structuren van fragmenten F04, F36 en F41. D) Schematische weergave van F04 gebonden aan site sID βαII. Residuen die de bindingsplaats vormen, worden weergegeven in groen voor hydrofoob, in lichtblauw voor polair en in donkerblauw voor geladen residuen. De interagerende residuen αL242 en αL252 worden niet getoond omdat ze zich onder het ligand bevinden. Waterstofbindingen worden aangegeven met gestippelde en π-stapelinteracties met ononderbroken zwarte lijnen. Rode stippen vertegenwoordigen kristallografische watermoleculen. Krediet:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202204052
Onderzoekers van het Paul Scherrer Instituut PSI en het Italiaanse Instituut voor Technologie IIT hebben een nieuwe stof ontwikkeld die een eiwit in het celskelet uitschakelt, wat leidt tot celdood. Op deze manier kunnen dergelijke stoffen bijvoorbeeld de groei van tumoren tegengaan. Om dit te bereiken, combineerden de onderzoekers een structurele biologische methode met het computationele ontwerp van actieve middelen. De studie verscheen in het tijdschrift Angewandte Chemie International Edition .
Het celskelet, ook wel het cytoskelet genoemd, doordringt al onze cellen als een dynamisch netwerk van draadachtige eiwitstructuren. Het geeft cellen hun vorm, helpt bij het transport van eiwitten en grotere celcomponenten en speelt een cruciale rol bij de celdeling. De centrale bouwsteen is het eiwit tubuline. Het rangschikt zichzelf in buisvormige structuren, de microtubuli-filamenten.
Actieve middelen die zich hechten aan het celskelet behoren tot de meest effectieve geneesmiddelen tegen kanker. Ze blokkeren tubuline en voorkomen zo celdeling in tumoren. PSI-onderzoekers hebben nu, in samenwerking met het Italiaanse Instituut voor Technologie in Genua, een andere krachtige stof ontwikkeld die tubuline onbruikbaar maakt. Ze hebben het "Todalam" genoemd.
"Todalam voorkomt dat tubuline zichzelf schikt in de vorm van microtubuli-filamenten", legt eerste auteur Tobias Mühlethaler uit, die de stof mede heeft ontworpen en bestudeerd als onderdeel van zijn promotieonderzoek bij PSI. "Het eiwit blijft als bevroren in een structuur die niet in microtubuli past."
Rationeel ontworpen
Er zijn meestal twee verschillende benaderingen voor het ontwikkelen van nieuwe medicijnen:onderzoekers kunnen een enorm aantal moleculen testen om de veelbelovende eruit te vissen, of ze kunnen specifiek chemische moleculen ontwerpen die het gewenste effect bereiken. De PSI- en IIT-onderzoekers kozen voor de tweede weg, die vaak moeilijker is.
Daarbij konden ze voortbouwen op hun eigen grondwerk, onderzoek waarin ze al plekken in tubuline hadden gelokaliseerd waar moleculen bijzonder goed kunnen aanmeren. Dit zijn de zogenaamde bindingspockets, waarvan ze er 27 vonden. Daarnaast identificeerden de onderzoekers 56 fragmenten die aan deze sites binden. Ook dit werk was eerder gepubliceerd in Angewandte Chemie International Edition .
In de huidige studie op basis van dit eerdere werk, selecteerden de onderzoekers aanvankelijk een nieuw ontdekte bindende pocket op tubuline. Ze gebruikten computationeel ontwerp om de structuren van drie moleculaire fragmenten, die bij voorkeur op dit punt aanmeren, te combineren tot een enkele chemische verbinding, en vervolgens synthetiseerden ze deze in het laboratorium. "Door de drie fragmenten in één molecuul te combineren, hoopten we het effect te versterken, omdat het nieuwe molecuul de bindingsholte beter vult", zegt Michel Steinmetz, hoofd van het Laboratorium voor Biomoleculair Onderzoek bij PSI.
Met behulp van metingen bij de Swiss Light Source SLS controleerden de onderzoekers hoe goed het molecuul daadwerkelijk in de bindingszak past. In nog twee cycli verbeterden ze de substantie tot ze bij Todalam aankwamen. "Met relatief eenvoudige chemie zijn we erin geslaagd om tot een krachtige verbinding te komen", zegt Andrea Prota, een wetenschapper in de Steinmetz-groep die nauw samenwerkte met Mühlethaler.
Eenvoudige chemische structuur
In celculturen toonden de onderzoekers aan dat Todalam cellen doodt. Geen wonder, aangezien tubuline essentieel is voor het leven. "Hoe beter een stof bindt aan een kritieke plaats in tubuline, hoe giftiger het is voor de cellen", legt Steinmetz uit. Dat maakt Todalam een veelbelovend startpunt voor het ontwikkelen van een medicijn.
De cytoskeletremmers die momenteel klinisch worden gebruikt, zijn natuurlijke stoffen met grote, complexe structuren en zijn daarom moeilijk te synthetiseren. De nieuw ontwikkelde verbinding Todalam daarentegen kan in een eenvoudige chemische synthese in het laboratorium worden geproduceerd. "Dat betekent ook dat de verbinding relatief gemakkelijk in grote hoeveelheden kan worden geproduceerd", benadrukt Steinmetz. + Verder verkennen
Celcytoskelet als doelwit voor nieuwe actieve stoffen
 Metaal-organische raamwerken kunnen ondanks de aanwezigheid van water gassen scheiden
Metaal-organische raamwerken kunnen ondanks de aanwezigheid van water gassen scheiden Chiton-weekdier biedt model voor nieuw pantserontwerp
Chiton-weekdier biedt model voor nieuw pantserontwerp Bio-sensing contactlens kan op een dag bloedglucose meten, andere lichaamsfuncties
Bio-sensing contactlens kan op een dag bloedglucose meten, andere lichaamsfuncties Een nieuwe oplossing voor afvalwaterzuivering
Een nieuwe oplossing voor afvalwaterzuivering Histonmodificaties lezen, een oncoproteïne wordt in ruil daarvoor gewijzigd
Histonmodificaties lezen, een oncoproteïne wordt in ruil daarvoor gewijzigd
Hoofdlijnen
- Hoe werkt ureum denaturisch?
- Mendelian Vs. Moderne genetica
- Cyanobacteriële studies onderzoeken de celstructuur tijdens stikstofgebrek
- Europese topkoks schrappen elektrisch pulsvissen van het menu
- Darmbacteriën veroorzaken indirect symptomen door het microbioom van fruitvliegen te veranderen
- Van Alaska tot Amazonia:de eerste wereldwijde kaarten met eigenschappen die de groei van vegetatie stimuleren
- Onderzoekers creëren nieuwe letters om DNA-functies te verbeteren
- Er is een gemakkelijke manier om mitose en meiose te begrijpen
- Een 3D-model van een plantencel bouwen
- Onderzoekers gebruiken machine learning-techniek om nieuwe overgangsmetaalverbindingen snel te evalueren

- Van oude spijkerbroek naar nieuw T-shirt

- Hoe moleculen op oppervlakken zitten, stimuleert de overdracht van energie en elektronen

- Het op maat maken van het oppervlak van koolstof kan de sleutel zijn tot het in realtime monitoren van het bloed van de patiënt

- DNA-origami vol krachtige antikankermiddelen
 In de cellulaire wereld, sterke relaties de sleutel tot het helen van oude wonden
In de cellulaire wereld, sterke relaties de sleutel tot het helen van oude wonden Hoe BTU Output
Hoe BTU Output Klimaatverandering komt voor je snacks:waarom herhaalde droogte gedroogd fruit en groenten bedreigt
Klimaatverandering komt voor je snacks:waarom herhaalde droogte gedroogd fruit en groenten bedreigt Presidentiële inauguraties stimuleren toerisme, maar niet dit jaar
Presidentiële inauguraties stimuleren toerisme, maar niet dit jaar Lichtblauwe stip - of niet?
Lichtblauwe stip - of niet? Rood tij rollen:Schadelijke algen blijken te gedijen in zowel hoge, omgevingen met weinig CO2
Rood tij rollen:Schadelijke algen blijken te gedijen in zowel hoge, omgevingen met weinig CO2 Ultradunne digitale camera geïnspireerd op Xenos peckii-ogen
Ultradunne digitale camera geïnspireerd op Xenos peckii-ogen Verschillen tussen petroleumether en diethylether
Verschillen tussen petroleumether en diethylether
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

