
Wetenschap
Waarom heeft fluor een kleinere atoomstraal dan zowel zuurstof als chloor?
De trend van atoomstralen binnen een periode (rij) van het periodiek systeem neemt over het algemeen af van links naar rechts. Dit komt doordat het aantal protonen in de kern van links naar rechts toeneemt, wat leidt tot een sterkere aantrekkingskracht tussen de positief geladen kern en de negatief geladen elektronen. Deze verhoogde nucleaire lading trekt de elektronen dichter bij de kern, wat resulteert in een afname van de atoomstraal.
In het geval van fluor, zuurstof en chloor behoren alle drie de elementen tot dezelfde periode (periode 2). Fluor bevindt zich uiterst links, gevolgd door zuurstof en vervolgens chloor. Daarom heeft fluor de kleinste atoomstraal vergeleken met zuurstof en chloor, omdat het het laagste atoomnummer en de sterkste nucleaire lading heeft.
Hier is een samenvatting van de atoomstralen van fluor, zuurstof en chloor:
- Fluor (F):72 picometer (pm)
- Zuurstof (O):73 uur
- Chloor (Cl):99 uur
Zoals je kunt zien heeft fluor de kleinste atoomstraal van de drie elementen, wat consistent is met de trend van afnemende atoomstralen over een bepaalde periode.
 Ontbrekende atomen in een vergeten kristal brengen luminescentie
Ontbrekende atomen in een vergeten kristal brengen luminescentie Waarom worden vaste stoffen in een wetenschappelijk laboratorium niet in gootstenen neergezet?
Waarom worden vaste stoffen in een wetenschappelijk laboratorium niet in gootstenen neergezet?  Van identificatie tot chemische vingerafdruk voor explosieven in forensisch onderzoek
Van identificatie tot chemische vingerafdruk voor explosieven in forensisch onderzoek Die zal dissociëren wanneer deze in water wordt geplaatst. CH3OH b. HCl c. KBr d. HClO4?
Die zal dissociëren wanneer deze in water wordt geplaatst. CH3OH b. HCl c. KBr d. HClO4?  Kaliumjodaat covalente of ionische binding?
Kaliumjodaat covalente of ionische binding?
 Grote olie-investeringen wedden op het niet halen van klimaatdoelen:rapport
Grote olie-investeringen wedden op het niet halen van klimaatdoelen:rapport Rook van bosbranden in New England is behoorlijk ernstig vanuit het perspectief van de volksgezondheid
Rook van bosbranden in New England is behoorlijk ernstig vanuit het perspectief van de volksgezondheid Ruimtevaartuig onthult nieuwe details van magnetische herverbinding
Ruimtevaartuig onthult nieuwe details van magnetische herverbinding NASA schat tropische depressie Imeld als enorme regenval in Texas
NASA schat tropische depressie Imeld als enorme regenval in Texas Onderzoek suggereert dat mensen nu meer chemisch afval produceren dan getest kan worden
Onderzoek suggereert dat mensen nu meer chemisch afval produceren dan getest kan worden
Hoofdlijnen
- Precies weten wat genen zeggen – en waar
- Hoe schat ik de celgrootte met behulp van een microscoop?
- Hoe bacteriën een enzym bouwen dat klimaatveranderend lachgas vernietigt
- Wat maakt clowns zo griezelig?
- Honingbijen stemmen om te beslissen over nestplaatsen – waarom we zouden moeten luisteren
- Waarom is het belangrijk om lichaamsvet onder controle te houden bij mensen?
- Hoe reageren mannen en vrouwen op gendervooroordelen in STEM?
- Wat is functiebasis in een microscoop?
- Hoe geslachtsaanpassende chirurgie werkt
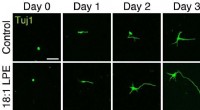
- Oleoyl-LPE oefent neurietstimulatie en neuroprotectie uit
- Onderzoekers onthullen op oxygenaat gebaseerde routes bij de omzetting van syngas via bifunctionele oxide-zeolietkatalysatoren

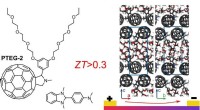
- Warmte omzetten in kracht met efficiënt organisch thermo-elektrisch materiaal
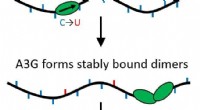
- Een als door te bewerken, twee als door wegversperring:menselijk eiwit bestrijdt HIV als monomeer en dimeer
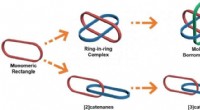
- Alles-in-één strategie voor metalla[3]catenanen, Borromeïsche ringen en ring-in-ring-complex
 NASA's Webb zal atmosferen zoeken rond potentieel bewoonbare exoplaneten
NASA's Webb zal atmosferen zoeken rond potentieel bewoonbare exoplaneten Nieuw teamwerkmodel kan de gezondheidszorg voor patiënten verbeteren
Nieuw teamwerkmodel kan de gezondheidszorg voor patiënten verbeteren Nanofractioneringsplatform met parallelle massaspecificatie voor ID-cytochroom-CYP1A2-remmers
Nanofractioneringsplatform met parallelle massaspecificatie voor ID-cytochroom-CYP1A2-remmers Een nikkelkatalysator met koolwaterstoffen gebruiken om vetzuren te maken
Een nikkelkatalysator met koolwaterstoffen gebruiken om vetzuren te maken Dieseltreinen kunnen passagiers blootstellen aan uitlaatgassen
Dieseltreinen kunnen passagiers blootstellen aan uitlaatgassen Wat innerlijke spraak is, en waarom de filosofie zich er bewust van wordt
Wat innerlijke spraak is, en waarom de filosofie zich er bewust van wordt  Waarom fruitvliegen de eerste dieren in de ruimte waren
Waarom fruitvliegen de eerste dieren in de ruimte waren  Eetbare, fluorescerende zijden tags kunnen nepmedicijnen opsporen
Eetbare, fluorescerende zijden tags kunnen nepmedicijnen opsporen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

