Wetenschap
Een als door te bewerken, twee als door wegversperring:menselijk eiwit bestrijdt HIV als monomeer en dimeer
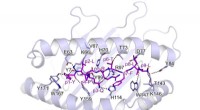
Onderzoek onlangs gepubliceerd in Natuurcommunicatie onderzoekt de mogelijkheden van een menselijk eiwit dat HIV-1 remt, APOBEC3G (A3G). De paper belicht het werk van Northeastern Physics Professor en Chair Mark Williams, postdoctoraal onderzoeker Mike Morse, Professor Linda Chelico, Universiteit van Saskatchewan in Canada, en Ioulia Rouzina, Universiteit van Ohio. Krediet:Mike Morse/Northeastern University
Vijftien jaar geleden, een klasse van eiwitten werd ontdekt, die mensen aangeboren immuniteit tegen HIV-1 geven. Helaas, HIV-1 is een slim virus en is geëvolueerd om deze eiwitten te bestrijden. Noordoost-onderzoekers, met hulp van hun medewerkers, bestuderen deze eiwitten al enkele jaren om hun functie en mechanismen beter te begrijpen in de hoop beter voorbereid te zijn tegen hiv-1.
Het onderzoek, gepubliceerd in Natuurcommunicatie , benadrukt het werk van Northeastern Physics Professor en Chair Mark Williams, postdoctoraal onderzoeker Mike Morse, Professor Linda Chelico, Universiteit van Saskatchewan in Canada, en Ioulia Rouzina, Universiteit van Ohio. Het artikel onderzoekt de mogelijkheden van een menselijk eiwit dat HIV-1 remt, APOBEC3G (A3G).
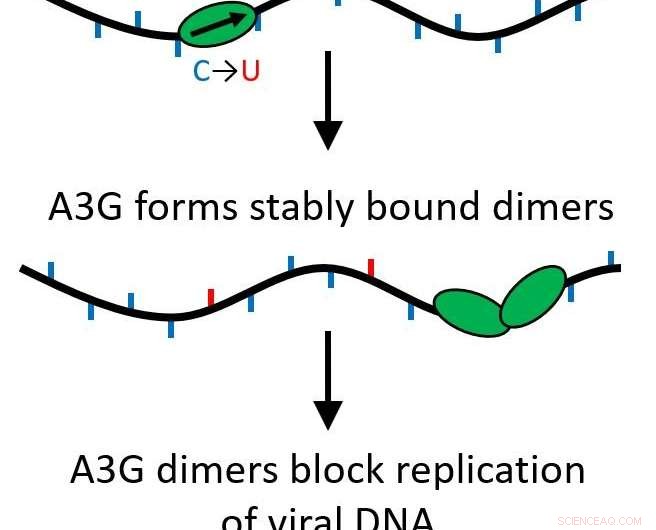
Hun bevindingen stelden vast dat wanneer het A3G-eiwit groeit van een enkel eiwit (monomeer) tot een twee-eiwitcomplex (dimeer), zijn functie wordt getransformeerd van een bewerkingseiwit dat viraal DNA muteert tot een wegversperring voor verdere replicatie van het virus.
"Ik was volledig verrast door het resultaat dat dimeren voldoende waren om dit te doen, " zei Williams. "We hebben onze gegevens, en de gegevens vertelden ons dit, maar het heeft lang geduurd voordat we ons realiseerden dat de enige manier om deze gegevens te begrijpen, is dat dimeren het model moeten zijn om de eigenschappen van het eiwit plotseling te veranderen."
Het Williams Laboratory for Single Molecule Biophysics is gespecialiseerd in instrumenten die optische pincetten worden genoemd en die moleculen bestuderen, zoals enkele DNA-moleculen of DNA-eiwitcomplexen. Deze tool houdt DNA of RNA tussen twee polystyreenkralen om interacties met het DNA te bekijken door veranderingen in lengte en spanning te observeren. Met behulp van deze techniek, het laboratorium bestudeert veel verschillende biologische systemen, waaronder HIV-1-replicatie. Door een combinatie van deze biofysische methoden met de enzymactiviteitsexperimenten en het creëren van mutante vormen van A3G door het Chelico-lab, konden Williams en Morse de oorspronkelijke vorm van het eiwit vergelijken met verschillende mutanten die structurele veranderingen bevatten. Dit maakte de isolatie van het proces mogelijk dat resulteerde in stabiel gebonden gedimeriseerd eiwit.
De afgelopen 12 jaar, het Williams-lab heeft hiv-1-replicatie bestudeerd met hulp van een NIH-subsidie. Hun meest recente project omvat het begrijpen van de aangeboren immuuneiwitten die mensen immuniteit geven tegen HIV-1. Er zijn zeven eiwitten in de APOBEC3-familie, waarvan sommige vechten tegen retrovirussen zoals HIV-1, terwijl anderen vechten tegen retrotransposons, Dit zijn genetische elementen die zichzelf binnen een genoom versterken en mogelijk ziekten kunnen veroorzaken.
Alle APOBEC-eiwitten zijn cytidinedeaminasen, waardoor ze enkelstrengs DNA kunnen modificeren om basen te vervangen, mutaties veroorzaken wanneer de streng wordt gerepliceerd. Echter, A3G heeft ook een andere functie die precies het tegenovergestelde doet. In plaats van snel langs het genoom te zippen en bewerkingen uit te voeren, het kan een stabiel bindend eiwit worden dat het proces van omgekeerde transcriptie remt, het voorkomen van hiv-1-replicatie. Dit gebeurt vanwege een proces dat oligomerisatie wordt genoemd, waarbij enkele eiwiteenheden (monomeren) samenkomen om multi-eiwitcomplexen of oligomeren te creëren.
"Het idee dat je zou kunnen inzoomen en deze veranderingen aanbrengt, en toch ook iets anders blokkeren om te bewegen, had niet echt zin, " zei Williams. "Daarom is de oligomerisatie zo belangrijk. Omdat ze snel beginnen en verder gaan, na verloop van tijd oligomeriseren ze en worden ze erg traag."
Dit team van onderzoekers ontdekte de oligomerisatie zoals gepubliceerd in hun paper uit 2014 in Natuurchemie . Hun studie toonde aan dat de groei van een multi-eiwitcomplex ervoor zorgde dat het eiwit vertraagt, maar het was niet bekend hoeveel eiwitten nodig waren om een langzaam complex te maken. Als het aantal hoog was, de resultaten zijn mogelijk niet relevant voor virale replicatie. In aanvulling, ze konden aantonen dat de complexen traag waren, maar ze konden niet zeggen of de langzame complexen enzymactiviteit hadden. Maar nu heeft hun nieuwe onderzoek de antwoorden op deze twee kritische vragen gevonden.
"Tussen onze experimenten waarbij we de binding van eiwitten aan DNA direct observeerden, en het werk van professor Chelico over de enzymatische activiteit van A3G, we vonden dat op korte tijdschalen in de monomere vorm, het eiwit bindt en dissocieert zeer snel van DNA en heeft een hoge enzymatische activiteit, "zei Morse. "Maar als je het eenmaal deze oligomeren laat vormen, de binding is veel stabieler, en dissocieert niet zo gemakkelijk. Professor Chelico ontdekte dat de enzymatische activiteit daadwerkelijk afneemt wanneer dit proces plaatsvindt, dus je hebt deze twee functies - de enzymatische activiteit die op eenmalige schaal plaatsvindt, en in één vorm, en deze secundaire functie die, door de oligomerisatie, gebeurt op een andere tijdschaal."
Hun onderzoek toonde aan dat dit zelfs gebeurt als slechts twee eiwitten samenkomen, een dimeer vormen. Het dimeer is voldoende om het eiwitcomplex stabiel te maken en de functie van het eiwit te veranderen. Aangezien er slechts een dimeer nodig is, meerdere wegversperringen kunnen optreden om te voorkomen dat reverse transcriptie optreedt. Nutsvoorzieningen, deze belangrijke functie is waarschijnlijker biologisch relevant.
"Weten hoe iets HIV-1 remt, zou een leidraad kunnen zijn bij het ontwerpen van nieuwe methoden voor anti-HIV-medicijnen. Het HIV-1-virus heeft zijn eigen eiwit ontwikkeld om de cel te misleiden tot het afbreken van APOBEC-eiwitten, dus als we erachter kunnen komen hoe we die degradatie kunnen stoppen, misschien kunnen we het vermogen van dit eiwit om HIV-1 te remmen verbeteren, ' zei Willems.
Het Williams Lab van de Northeastern University is van plan om door te gaan met het bestuderen van de verschillende APOBEC-eiwitten, andere remmen HIV-1 of retrotransposons. Door deze eiwitten te bestuderen met hun unieke biofysische meetinstrumenten, hun laboratorium hoopt de regulatie van de eiwitten te begrijpen, werkzaamheid, en processen om ons te helpen verder voorbereid te zijn op hiv en andere gerelateerde ziekten.
 De uitstoot van de mensheid 100 keer groter dan die van vulkanen
De uitstoot van de mensheid 100 keer groter dan die van vulkanen Waar is het centrum van Noord-Amerika? Geografen nieuwe methode vindt een nieuw antwoord
Waar is het centrum van Noord-Amerika? Geografen nieuwe methode vindt een nieuw antwoord Duiker filmt afvalland in de wateren van Bali
Duiker filmt afvalland in de wateren van Bali Stijgende toendratemperaturen zorgen voor zorgwekkende veranderingen in microbiële gemeenschappen
Stijgende toendratemperaturen zorgen voor zorgwekkende veranderingen in microbiële gemeenschappen Warm Front-kenmerken
Warm Front-kenmerken
Hoofdlijnen
- De rol van microben in de industrie
- Het doel van elektroforese
- Welke soorten cellen en organismen ondergaan mitose en meiose?
- Wat is de structuur van stamcellen?
- Zijn religies ontstaan uit ons verkeerde begrip van het menselijk bewustzijn?
- Noord-Amerikaanse primeur:onderzoekers publiceren wetenschappelijke studie over cannabisproductie
- Onderzoekers gebruiken het ritme van DNA-replicatie om kankercellen te doden
- In de mangoestenmaatschappij immigranten zijn een bonus - als ze tijd krijgen om zich te vestigen
- Wat doen onze lichaamscellen met zuurstof?
 Wetenschappers krijgen meer inzicht in een proces dat warmteverlies veroorzaakt in fusie-apparaten
Wetenschappers krijgen meer inzicht in een proces dat warmteverlies veroorzaakt in fusie-apparaten Hoe speciale rechtse driehoeken op te lossen
Hoe speciale rechtse driehoeken op te lossen Studie onthult waarom openbare oproepen mislukken bij sommige potentiële donoren
Studie onthult waarom openbare oproepen mislukken bij sommige potentiële donoren Nieuwe aanpak van wetenschappers verbetert efficiëntie van zonnecellen
Nieuwe aanpak van wetenschappers verbetert efficiëntie van zonnecellen Wetenschappers realiseren geruisloos foton-echo-protocol
Wetenschappers realiseren geruisloos foton-echo-protocol Experiment stuurt gemanipuleerde installaties naar ISS
Experiment stuurt gemanipuleerde installaties naar ISS Hoe kationen en anionen te berekenen
Hoe kationen en anionen te berekenen Door-de-muur radar op kleine chip heeft een enkele zender, drie ontvangers
Door-de-muur radar op kleine chip heeft een enkele zender, drie ontvangers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Swedish | German | Dutch | Danish | Italian | Portuguese | Norway |

-
Wetenschap © https://nl.scienceaq.com