
Wetenschap
Hoe bereken je het verschil in pH-sterkte van een oplossing?
```
pH =-log10[H3O+]
```
waarbij [H3O+] de concentratie waterstofionen in de oplossing is, in mol per liter (M).
Het pH-verschil tussen twee oplossingen kan worden berekend door de pH van de tweede oplossing af te trekken van de pH van de eerste oplossing:
```
pH-verschil =pH1 - pH2
```
Als de pH van een oplossing bijvoorbeeld 4 is en de pH van een andere oplossing 6, is het pH-verschil 6 - 4 =2. Dit betekent dat de tweede oplossing 2 eenheden basischer is dan de eerste oplossing.
Het pH-verschil kan ook worden gebruikt om de concentratie waterstofionen in een oplossing te berekenen, met behulp van de volgende vergelijking:
```
[H3O+] =10^-pH
```
Als de pH van een oplossing bijvoorbeeld 4 is, is de concentratie waterstofionen in de oplossing:
```
[H3O+] =10^-4 =1 × 10^-4 M =100 μM
```
 Nieuwe theorie laat zien hoe spanning zorgt voor betere katalysatoren
Nieuwe theorie laat zien hoe spanning zorgt voor betere katalysatoren Heeft het wonen in de buurt van een olie- of aardgasbron invloed op uw drinkwater?
Heeft het wonen in de buurt van een olie- of aardgasbron invloed op uw drinkwater?  Nieuw wereldrecord voor directe zonne-watersplitsingsefficiëntie
Nieuw wereldrecord voor directe zonne-watersplitsingsefficiëntie Welke eigenschap van een ester kan worden gebruikt om de zuiverheid ervan te controleren voordat deze als voedingsaroma wordt gebruikt?
Welke eigenschap van een ester kan worden gebruikt om de zuiverheid ervan te controleren voordat deze als voedingsaroma wordt gebruikt?  Wat is de polyatomaire naam voor CH3COO- en waarom is die formule nauwkeuriger?
Wat is de polyatomaire naam voor CH3COO- en waarom is die formule nauwkeuriger?
 Waar wordt het water gedistribueerd tijdens een droogte?
Waar wordt het water gedistribueerd tijdens een droogte?  Prenatale blootstelling aan bosbranden belemmert de groei van kinderen
Prenatale blootstelling aan bosbranden belemmert de groei van kinderen Gezondheidseffecten van de uitbarsting van Mount Nyiragongo zullen nog lang voelbaar zijn
Gezondheidseffecten van de uitbarsting van Mount Nyiragongo zullen nog lang voelbaar zijn Nucleair afval stapelt zich op:regeringen moeten stoppen met aarzelen en actie ondernemen
Nucleair afval stapelt zich op:regeringen moeten stoppen met aarzelen en actie ondernemen Microplasticvervuiling:wetenschappers leren nog steeds hoe het dieren in het wild schaadt
Microplasticvervuiling:wetenschappers leren nog steeds hoe het dieren in het wild schaadt
Hoofdlijnen
- Hoe erfelijke ziekten werken
- Hoe epigenetische schakelaars genexpressie controleren
- Wat is syngamie?
- Marmoset-baby's krijgen een boost van attente vaders
- Studie decodeert dimerisatie en herkenning van antidepressiva op de noradrenalinetransporteur
- De structuur en functie van spiercellen
- Metabolisme heeft een directe invloed op de kans op het ontwikkelen van malaria
- Kunnen mensen nog ouder worden? We hebben het maximale nog niet bereikt, zeggen sommige wetenschappers
- Hoe ziekteverwekkers mitochondriale afweermechanismen kunnen uitschakelen
- Nanotechnologie stelt ingenieurs in staat om voorheen niet-lasbare aluminiumlegeringen te lassen

- Gepersonaliseerde zweetsensor meet betrouwbaar de bloedglucose zonder vingerprikken

- Patiënten moeten het lab overslaan, krijg onmiddellijke resultaten met nieuwe bloedtesttechnologie

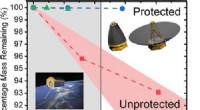
- Doorbraakmateriaal kan satellieten beschermen tegen ultraviolette straling en atomaire zuurstof in een lage baan om de aarde
- Studie onthult een unieke manier van celmigratie op zachte visco-elastische oppervlakken
 Licht gebruiken om communicatie te versleutelen
Licht gebruiken om communicatie te versleutelen Bio-geïnspireerd materiaal bootst kleurveranderingen van levende organismen na
Bio-geïnspireerd materiaal bootst kleurveranderingen van levende organismen na Fysische virologie toont de dynamiek van virusreproductie
Fysische virologie toont de dynamiek van virusreproductie Een regenboog van kleuren verfijnen op nanoschaal
Een regenboog van kleuren verfijnen op nanoschaal Onderzoekers:We hebben gekeken naar al het recente bewijsmateriaal over het verbod op mobiele telefoons op scholen – dit is wat we hebben gevonden
Onderzoekers:We hebben gekeken naar al het recente bewijsmateriaal over het verbod op mobiele telefoons op scholen – dit is wat we hebben gevonden  Wat is de oxidatietoestand van N in salpeterzuur HNO3?
Wat is de oxidatietoestand van N in salpeterzuur HNO3?  Team ontwikkelt een eerlijker rankingsysteem dat de zoekresultaten diversifieert
Team ontwikkelt een eerlijker rankingsysteem dat de zoekresultaten diversifieert Wat wordt bedoeld met diamorfisme?
Wat wordt bedoeld met diamorfisme?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

