
Wetenschap
Hoe reageert methanol met water?
CH3OH + H2O → CH3OH2+ + OH-
Bij deze reactie doneert het methanolmolecuul een proton (H+) aan het watermolecuul, wat resulteert in de vorming van een hydroniumion (CH3OH2+) en een hydroxide-ion (OH-). Het hydroniumion is in wezen een geprotoneerd methanolmolecuul, terwijl het hydroxide-ion een vrije hydroxylgroep is.
De mate waarin methanol hydrolyse ondergaat, hangt af van verschillende factoren, waaronder de temperatuur, de concentratie van de zure katalysator en de aanwezigheid van andere reactanten of oplosmiddelen. Onder normale omstandigheden is de hydrolyse van methanol een relatief langzame reactie. Het kan echter worden versneld door de temperatuur te verhogen of door een sterkere zure katalysator te gebruiken.
De producten van de hydrolysereactie, hydroniumionen en hydroxide-ionen, kunnen verder met elkaar reageren of met andere reactanten die in de oplossing aanwezig zijn. In aanwezigheid van een sterke base, zoals natriumhydroxide (NaOH), zullen de hydroniumionen bijvoorbeeld reageren met de hydroxide-ionen om water te vormen, terwijl de methanol niet reageert.
CH3OH2+ + OH- → CH3OH + H2O
Over het geheel genomen is de reactie tussen methanol en water een omkeerbaar proces, en het evenwicht tussen methanol, hydroniumionen en hydroxide-ionen kan worden verschoven afhankelijk van de reactieomstandigheden.
 Wat is zuiver water op de pH-schaal?
Wat is zuiver water op de pH-schaal?  Bevordering van weefselmanipulatie met hydrogels met vormgeheugen
Bevordering van weefselmanipulatie met hydrogels met vormgeheugen  Onderzoekers werpen licht op hoe fotopolymerisatie veel efficiënter kan worden gemaakt
Onderzoekers werpen licht op hoe fotopolymerisatie veel efficiënter kan worden gemaakt  Galvaniseren levert hoge energie, krachtige batterijen
Galvaniseren levert hoge energie, krachtige batterijen Een nieuwe rekbare batterij kan draagbare elektronica van stroom voorzien
Een nieuwe rekbare batterij kan draagbare elektronica van stroom voorzien
 Nieuwe infrageluidsensorarray van Sandia detecteert explosies
Nieuwe infrageluidsensorarray van Sandia detecteert explosies Om mosselen op te bouwen, je moet je vissen kennen
Om mosselen op te bouwen, je moet je vissen kennen Where Are Bogs Located?
Where Are Bogs Located?  Branden brengen klimaatgedreven urgentie naar huis om te heroverwegen waar - en hoe - we leven
Branden brengen klimaatgedreven urgentie naar huis om te heroverwegen waar - en hoe - we leven Onderzoekers documenteren de oudst bekende bomen in het oosten van Noord-Amerika
Onderzoekers documenteren de oudst bekende bomen in het oosten van Noord-Amerika
Hoofdlijnen
- Ideeën voor het maken van een 3D-model van een cel
- Kan JWST het verschil zien tussen een exoEarth en exoVenus?
- Wetenschappers laten zien dat Urm1 eiwitten beschermt in stresssituaties
- De gezondheid van larven van een Antarctische koudwaterkoraalsoort kan resistent zijn tegen opwarmend water
- De meest voorkomende organische moleculen in cellen
- Numerieke simulaties laten zien hoe de eiwitfunctie wordt beïnvloed door de van nature verstopte omgeving
- Hoe voorspelbaar is evolutie?
- Hoe virussen het cellulaire immuunsysteem te slim af zijn
- Welke plantachtige kenmerken hebben euglenoïden?
- Onderzoekers ontdekken nieuwe klasse van chemische reacties
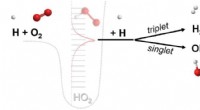
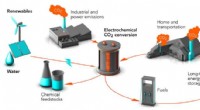
- Kunststoffen, brandstoffen en chemische grondstoffen uit CO2? Ze werken eraan
- Een methode bij lage temperaturen voor het maken van hoogwaardige thermo-elektrische materialen

- Gemanipuleerde enzymen - onderzoekers zetten mijlpaal in onderzoek naar biokatalyse

- Meer dan H2O:technologie meet gelijktijdig 71 elementen in water, andere vloeistoffen

 Aan het koor:Vooruitstrevende faculteiten die innovaties vooral onderling delen
Aan het koor:Vooruitstrevende faculteiten die innovaties vooral onderling delen Lidar-systeem met één foton in de lucht bereikt 3D-beeldvorming met hoge resolutie
Lidar-systeem met één foton in de lucht bereikt 3D-beeldvorming met hoge resolutie  Mineraalrijke zeebodem en DDT-stortplaatsen onthullen nieuwe methaansijpeling, walvis vallen
Mineraalrijke zeebodem en DDT-stortplaatsen onthullen nieuwe methaansijpeling, walvis vallen Op koers voor gezonder, duurzamere bodem
Op koers voor gezonder, duurzamere bodem Kunstmatige cellen produceren delen van virussen voor veilige studies
Kunstmatige cellen produceren delen van virussen voor veilige studies Dierlijke aanpassingen rond vulkanen
Dierlijke aanpassingen rond vulkanen  Wat zijn de energieoverdrachten in een opwindbare radio?
Wat zijn de energieoverdrachten in een opwindbare radio?  Deepwater Horizon-olie heeft een dramatisch effect op de zintuiglijke vermogens van pijlstaartroggen
Deepwater Horizon-olie heeft een dramatisch effect op de zintuiglijke vermogens van pijlstaartroggen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

